К. с. с анионами кислот во внутренней сфере (ацидокомплексы) — наиболее типичные представители неорганических комплексов. Самым распространённым лигандом является вода . При растворении простых солей в воде образуются аквокомплексы, например, по схеме CoCl2 + 6H2 O=[Co (H2 O)6 ]2+ + 2Cl. Кристаллические аквокомплексы называются кристаллогидратами.
При растворении солей в различных органических и неорганических жидкостях образуются разнообразные сольватокомплексы. Кристаллические сольватокомплексы называют кристаллосольватами. К ним относятся продукты присоединения аммиака — аммиакаты , например [Ni (NH3 )6 ] Cl2 , продукты присоединения спирта — алкоголяты, эфира — эфираты и т. д. Сложные молекулы присоединяются к центральному атому через атомы кислорода (вода, спирты, эфиры и т. п.), азота (аммиак, его органические производные — амины), фосфора (PCl3 , производные фосфина), углерода и др. Часто лиганд присоединяется к центральному атому несколькими из своих атомов. Такие лиганды называют полидентатными. Среди сложных органических производных встречаются лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью атомами (соответственно би-, три-, тетра-, пента-, гекса- и октадентатные лиганды). Полидентатные органические лиганды могут образовать циклические комплексы типа неэлектролитов (см. Внутрикомплексные соединения ), например:
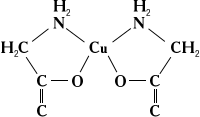
Самыми лучшими лигандами в смысле устойчивости образуемых ими К. с. являются комплексоны — аминополикарбоновые кислоты, среди которых наибольшее распространение получила этилендиаминтетрауксусная кислота
(HOOCCH2 )2 NCH2 CH2 N (CH2 COOH)2 (комплексон II, ЭДТА).
Неорганические ацидолиганды обычно моно-, реже бидентатны. Например, в соединении (NH4 )2 [Ce (NO3 )6 ] каждая NO3 -группа присоединяется к атому церия двумя атомами кислорода и является бидентатной. К. ч. Се в этом соединении равно 12.
Между К. с. и обычными (простыми) соединениями нет определённой границы. Одни и те же вещества, в зависимости от поставленных задач исследования, часто можно рассматривать и как простые и как комплексные. Например, в любом кристаллическом неорганическом веществе атомы, обычно относимые к комплексообразователям, обладают определённым К. ч. и, следовательно, ближайшей сферой, принципиально не отличимой от аналогичной группировки в обычном К. с.
Теория строения К. с. берёт своё начало от представлений А. Вернера (1893), который ввел важные для целого исторического периода понятия «главной» и «побочной» валентности, а также представления о координации, координационном числе, геометрии комплексной молекулы. Значительный вклад в исследование химии К. с., и, в частности, в установление связи между строением К. с. и реакционной способностью координированных групп, внесли советские учёные Л. А. Чугаев , И. И. Черняев и др.
Однако классическая координационная теория оказалась бессильной объяснить причины образования К. с. некоторых новых классов, предсказать их строение, а также установить взаимосвязь между строением и физическими свойствами К. с.
Удовлетворительное разрешение этих вопросов стало возможным лишь на базе современных квантово-механических представлений о природе химической связи. Подробнее см. Валентность , Квантовая химия , Молекулярных орбиталей метод , Химическая связь .
К. с. находят широкое применение для выделения и очистки платиновых металлов, золота, серебра, никеля, кобальта, меди, в процессах разделения редкоземельных элементов, щелочных металлов и в ряде других технологических процессов. К. с. широко используют в химическом анализе для качественного обнаружения и количественного определения самых разнообразных элементов. В живых организмах различные типы К. с. представлены соединениями ионов металлов (Fe, Cu, Mg, Mn, Mo, Zn, Со) с белками (т. н. металлопротеиды ), а также витаминами, коферментами, транспортными и др. веществами, выполняющими специфические функции в обмене веществ. Особенно велика роль природных К. с. в процессах дыхания, фотосинтеза , окисления биологического , в ферментативном катализе .
Лит.: Современная химия координационных соединений, под ред. Дж. Льюиса и Р. Уилкинса, пер. с англ., М., 1963; Берсукер И. Б., Аблов А. В., Химическая связь в комплексных соединениях, Кишинев, 1962; Гринберг А. А., Введение в химию комплексных соединений, 2 изд., Л. — М., 1951; Дей К., Селбин Д., Теоретическая неорганическая химия, пер. с англ., М., 1971; Головня В. А., Федоров И. А., Основные понятия химии комплексных соединений, М., 1961; Яцимирский К. Б., Термохимия комплексных соединений, М., 1951; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 1—3, М., 1969.
Б. Ф. Джуринский.
Комплексные удобрения
Ко'мплексные удобре'ния, удобрения, содержащие 2—3 основных питательных вещества (N, P2 O5 , K2 O) растений. В состав их можно ввести микроэлементы (В, Mn, Cu, Zn, Zn, Мо и другие). К. у. в основном высококонцентрированные (содержат повышенное количество питательных веществ и мало балласта), поэтому по сравнению с простыми удобрениями требуют меньше труда и средств на их внесение, хранение и перевозки. Они обладают хорошими физическими свойствами — не слёживаются, хорошо рассеваются при внесении машинами. Соотношение питательных веществ в К. у. различно, что зависит от способа производства, исходных компонентов, потребности растений. К. у. стали широко применять после 1950, особенно в США, Канаде, Англии, Нидерландах, Японии, Франции, Италии, где производство их составляет более 50% всего кол-ва удобрений. В СССР в 1971—75 выпуск высококонцентрированных и сложных К. у. намечено довести до 80% общего количества удобрений. К. у. подразделяют на двойные (фосфорно-калийные, азотно-фосфорные, азотно-калийные) и тройные (азотно-фосфорно-калийные). В зависимости от способа производства они бывают сложные, сложно-смешанные и смешанные. К. у. применяют под все культуры, сложные удобрения — в первую очередь под технические (хлопчатник, сахарную свёклу и др.).
Сложные удобрения получают при химическом взаимодействии исходных компонентов — аммиака, фосфорной и азотной кислот, фосфоритов, апатитов, калийных природных солей и др. Выпускают в гранулированном виде. Наиболее распространены из них в СССР: аммофос (содержание питательных веществ 56—64%), диаммофос (71—74%), нитрофос (38%), калийная селитра (57%), нитроаммофоска (50—54%), нитрофоска (36%). Перспективны сложные жидкие удобрения , а также калия метафосфат , аммония полифосфат и др.
Сложно-смешанные удобрения получают смешиванием готовых удобрений с последующей обработкой их серной и азотной кислотами, аммиаком или аммиакатами. Содержание питательных веществ в них зависит от исходных компонентов — до 58%. В СССР для внесения под сахарную свёклу выпускают сложно-смешанные удобрения, которые содержат азота, фосфора и калия соответственно 4, 16 и 8% и 3, 12 и 6%, а также более концентрированные туки — до 45% питательных веществ.
Смешанные удобрения — продукт механического смешивания готовых удобрений (в основном суперфосфата с азотными удобрениями и хлористым калием). Во избежание потери питательных веществ соблюдают правила смешивания, например, нельзя смешивать аммиачную селитру и другие аммиачные удобрения с термофосфатами, золой и другими щелочными удобрениями, так как при этом теряется азот; аммиачную селитру с мочевиной ввиду очень высокой гигроскопичности получаемой смеси. Для улучшения физических свойств смесей в них вносят нейтрализующие добавки: известняк, доломит, цементную пыль и другие. Лучшие смешанные удобрения получают при смешивании гранулированных компонентов. Соотношение питательных веществ в смешанных удобрениях зависит от потребности культуры и свойств почвы, например для основного удобрения под зерновые, сахарную свёклу, картофель, овощные на дерново-подзолистых, серых лесных и чернозёмных почвах соотношение азота, фосфора и калия (N: P2 O5 : K2 O) — 1:1:1; для припосевного внесения под зерновые, овощные и технические культуры — 1:1,5:1.