Вопрос о дальнейшей разработке квантовой теории получил новое освещение в результате открытия атомного ядра Резерфордом (1911 г.). Мы уже видели, как после этого открытия стало очевидным, что с помощью одних только классических представлений оказывается невозможным понять наиболее существенные свойства атомов. Поэтому начались поиски такой формулировки принципов квантовой теории, которая могла бы объяснить устойчивость строения атомов и свойства излучения, испускаемого атомами, из которых состоит вещество. Подобная формулировка была предложена мной в 1913 г. в виде двух постулатов, содержание которых можно выразить следующим образом.
1. Среди всех мыслимо возможных состояний движения атомной системы существует ряд так называемых стационарных состояний, которые, несмотря на то, что движение частиц в этих состояниях подчиняется в значительной степени законам классической механики, обладают своеобразной устойчивостью, необъяснимой в рамках классической теории, в результате чего всякое изменение движения системы должно состоять в переходе из одного стационарного состояния в другое.
2. В самих стационарных состояниях, в противоречии с классической электромагнитной теорией, атом не излучает. Однако процесс перехода между двумя стационарными состояниями может сопровождаться испусканием электромагнитного излучения, обладающего теми же свойствами, что и излучение, посылаемое согласно классической теории электрически заряженной частицей, совершающей гармонические колебания с постоянной частотой. Однако эта частота не находится в простом отношении к движению атома, а определяется условием
ℎν = 𝐸' - 𝐸'',
где ℎ — постоянная Планка; 𝐸' и 𝐸'' — значения энергии атома в двух стационарных состояниях, представляющих соответственно начальное и конечное состояние атома в процессе излучения. Облучение атома электромагнитными волнами этой частоты может привести к процессу поглощения, переводящему атом из конечного состояния в начальное.
Тогда как первый постулат подчёркивает общую устойчивость атома, второй прежде всего имеет в виду существование спектров, состоящих из резких линий. Более того, квантовое условие, определяемое вторым постулатом, является исходным пунктом для интерпретации спектральных законов. Самый общий из этих законов, комбинационный принцип, установленный Ритцом, гласит, что частота для каждой линии спектра некоторого элемента может быть представлена формулой
ℎν = 𝑇'' - 𝑇',
где 𝑇'' и 𝑇' — два так называемых спектральных терма, принадлежащих к совокупности термов, характерных для данного элемента.
В соответствии с нашими постулатами этот закон находит немедленное объяснение с помощью предположения о том, что спектр соответствует переходам между стационарными состояниями, в которых численные значения энергии атома равняются значениям спектральных термов, умноженных на постоянную Планка. Такое толкование комбинационного принципа существенно отличается от обычных электродинамических представлений отсутствием простой связи между движением атома и излучаемым светом. Отличие наших соображений от представлений, используемых обычно при описании явлений природы, станет совершенно очевидным, если обратить внимание на то, что появление двух спектральных линий, соответствующих комбинациям одного и того же спектрального терма с двумя другими термами, означает, что свойства излучения атома определяются не только состоянием атома в начале процесса излучения, но зависят также и от того состояния, в которое атом перейдёт в результате этого процесса.
Поэтому на первый взгляд могло бы показаться, что изложенное формальное толкование комбинационного принципа едва ли удастся связать с нашими представлениями о строении атома, основанными на экспериментальных данных, трактуемых с помощью классической механики и электродинамики. Более подробное исследование показало, однако, что на основании этих постулатов можно установить определённую связь между спектрами элементов и строением их атомов.
Спектр водорода
Спектр водорода является простейшим из всех известных нам спектров. Частоты линий этого спектра могут быть описаны с большой точностью формулой Бальмера
ν=𝐾
⎧
⎪
⎩
1
(𝑛'')²
-
1
(𝑛')²
⎫
⎪
⎭
,
где 𝐾 — постоянная, а 𝑛' и 𝑛'' — два целых числа. В этом спектре мы встречаемся, следовательно, с одним рядом спектральных термов вида 𝐾/𝑛², которые регулярно убывают по мере возрастания числа 𝑛. Поэтому в согласии с постулатами мы будем полагать, что каждая линия спектра водорода соответствует переходу между двумя стационарными состояниями из ряда таких состояний атома водорода, причём численное значение энергии атома в этих состояниях равно ℎ𝐾/𝑛².
Согласно нашей картине строения атома, водородный атом состоит из положительно заряженного ядра и одного электрона; периодическая орбита движения электрона с достаточно хорошей степенью точности может рассматриваться как эллипс, в одном из фокусов которого находится ядро. Большая ось орбиты обратно пропорциональна работе, которую нужно совершить для удаления электрона от ядра на бесконечное расстояние, а в соответствии со сказанным выше эта работа в стационарных состояниях в точности равна ℎ𝐾/𝑛². Следовательно, мы приходим к совокупности стационарных состояний, для которых большая ось электронной орбиты принимает ряд дискретных значений, пропорциональных квадрату целого числа. Эти соотношения схематически изображены на рис. 2. Для простоты электронные орбиты в стационарных состояниях изображены в виде окружностей, хотя в действительности теория не накладывает никаких ограничений на эксцентриситет орбит и определяет только длину большой оси. Стрелки обозначают процессы перехода, соответствующие красной и зелёной линиям водорода, 𝐻α и 𝐻β, для которых соответствующие частоты колебаний определяются формулой Бальмера при 𝑛'' = 2, 𝑛' = 3 и 4. Кроме того, на рис. 2 изображены процессы переходов, отвечающие трём первым линиям серии в ультрафиолетовой области, открытой в 1914 г. Лайманом; частоты их даются той же формулой при 𝑛'' = 1. Там же указан процесс перехода, соответствующий первой линии инфракрасной серии, открытой Пашеном несколькими годами раньше и задаваемой той же формулой при 𝑛'' равном 3.
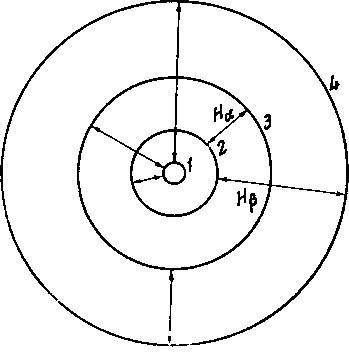
Рис. 2
Такое объяснение возникновения спектра водорода приводит совершенно естественно к интерпретации этого спектра как проявления способа связывания электрона с ядром атома. Наибольший спектральный терм с номером 1 соответствует конечной стадии этого процесса связывания, а меньшие термы, определяемые большими номерами, соответствуют стационарным состояниям, представляющим начальные стадии процесса связывания, когда орбиты электрона обладают ещё значительными размерами, а работа, требуемая для удаления электрона из атома, мала. Конечную стадию процесса связывания мы можем рассматривать как нормальное состояние атома. Оно отличается от других стационарных состояний тем свойством, что в согласии с нашими постулатами это состояние атома может быть изменено только при затрате энергии, в результате чего можно перевести электрон на одну из орбит с большими размерами, соответствующую ранней стадии процесса связывания.
Размер электронной орбиты в нормальном состоянии, вычисленный в рамках данной интерпретации спектра, приблизительно равен значениям, полученным для размеров атомов разных элементов с помощью кинетической теории вещества из свойств газов. Поскольку, однако, вследствие стабильности стационарных состояний, требуемой постулатами, нам приходится предполагать, что взаимодействие между двумя атомами при столкновении не может быть полностью описано с помощью законов классической механики, такое сравнение не может быть проведено до конца на основе лишь высказанных выше соображений.