Однако, обращаясь к теории атома, мы видим, что находимся в странном положении. С одной стороны, об объяснении в указанном смысле не может быть и речи, так как приходится иметь дело с явлениями, по самой природе вещей более простыми, чем явления в любой другой области наблюдения, где они всегда обусловлены взаимодействием большого числа атомов. Мы вынуждены поэтому быть скромнее в наших требованиях и должны удовлетворяться представлениями, являющимися формальными в том смысле, что они не обладают той наглядностью, которую мы привыкли требовать от понятий, с которыми оперируют естественнонаучные теории. В частности, имея это в виду, я пытался дать вам представление о другой стороне теории — о том, что её результаты, по крайней мере до некоторой степени, соответствуют ожиданиям, которые можно иметь по отношению ко всякой теории; я стремился показать, каким образом развитие теории атома привело к классификации обширных областей наблюдения и указало путь пополнения этой классификации предсказанием новых фактов. Однако едва ли нужно подчёркивать, что теория в значительной степени находится ещё в начальной стадии своего развития и что существует ещё много фундаментальных вопросов, ожидающих своего решения.
23 РЕНТГЕНОВСКИЕ СПЕКТРЫ И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ *
(Совместно с Д. Костером)
*Rontgenspentren und periodisches System der Elemente. (Mit D. Coster). Zs. f. Phys., 1923, 12, 342-374.
В работе, опубликованной в этом журнале, 1 один из авторов развил в основных чертах теорию строения атома, на основе которой представляется возможным дать интерпретацию оптических и рентгеновских спектров, тесно связанную с пониманием периодической системы элементов. После появления этой работы экспериментальный рентгеноспектроскопический материал, пригодный для проверки теоретических представлений, значительно расширился благодаря исследованиям второго из нас. В опубликованной недавно работе 2 обсуждалось отношение этих данных к теории, причём было выявлено несколько интересных результатов. В настоящей совместной работе экспериментальный материал сравнивается с теорией несколько точнее, чем в упомянутых работах, причём обращается особое внимание на роль рентгеновских спектров для объяснения периодической системы.
1 N. Воhr. Zs. f. Phys., 1922, 9, 1 (статья 19.) Тем временем эта работа, снабжённая некоторыми поясняющими рисунками, вместе с двумя другими сочинениями общего характера появилась в качестве отдельного сборника в издательстве «Фивег» под названием «Drei Aufsätze über Spektren und Atombau». Авторы намерены в ряде статей в настоящем журнале подробнее обсудить результаты этой работы, касающиеся как общих основ теории, так и отдельных частных подробностей.
2 D. Coster. Phil. Mag., 1922, 43, 1070; 1922, 44, 546; см. также: Dissertation, Leiden, 1922.
§ 1. Теоретические представления о строении атома. Упомянутая теория зиждется на классификации электронных орбит в атоме путём их сравнения со стационарными состояниями электрона, движущегося в центральном поле. Орбиты обозначаются символом 𝑛𝑘. Здесь 𝑛 означает входящее в формулу Бальмера для спектра водорода так называемое главное квантовое число, которое в предельном случае, когда центральное движение переходит в простое периодическое кеплеровское движение, является решающим для определения энергии. «Вспомогательное квантовое число» 𝑘, влияние которого на энергию обусловлено отклонением движения от простого периодического, определяет хорошо известным образом момент импульса электрона относительно центра орбиты. На введении этого квантового числа основана, как известно, зоммерфельдовская теория тонкой структуры линий водорода. Эта тонкая структура обусловлена тем, что, согласно релятивистской модификации законов механики, уже движение одного единственного электрона вокруг положительно заряженного атомного ядра не является строго периодическим, оно может быть описано как медленное вращение кеплеровского эллипса в своей плоскости. В табл. 1 (см. стр. 443, 444) для случая нормального атома приводятся числа электронов, принадлежащих согласно теории различным типам 𝑛𝑘-орбит; эта таблица выражает представления о строении атома, которые, отвлекаясь от новых характерных черт, во многих отношениях схожи с лежащими в основе работы Зоммерфельда и Вегарда о рентгеновских спектрах.
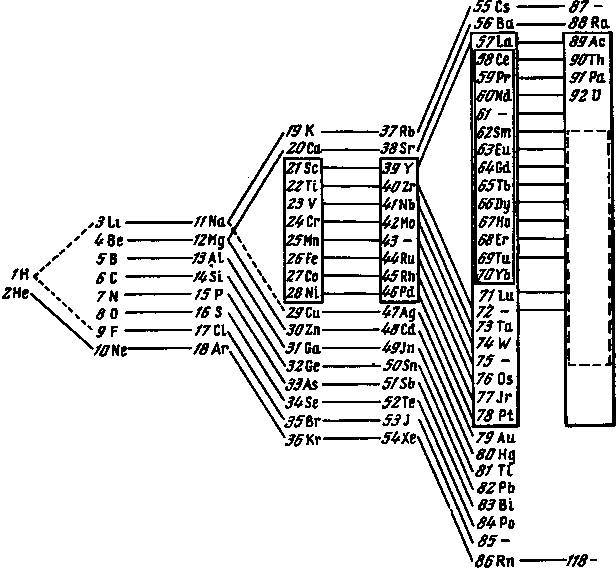
Рис. 1
Как видно, электронные орбиты расположены по группам, относящимся к одному и тому же значению главного квантового числа 𝑛. Образование этих групп при переходе к элементам с более высоким атомным номером связывалось с закономерностями в периодической системе. При этом существенной чертой является разделение этих групп на подгруппы, которым соответствуют различные значения вспомогательных квантовых чисел 𝑘. Постепенное добавление новых типов электронных орбит с тем же квантовым числом, что и у групп электронных орбит, имеющихся в предшествующих элементах, и продолжаемое этим постепенное образование групп дальше рассматривается как основа типичных отклонений от простой периодичности в системе элементов (металлы групп железа и платины, а также редкие земли). Обзор периодической системы, при котором особенно выступают эти черты, дан на рис. 1 1, где элементы, принадлежащие одному и тому же периоду системы, расположены в вертикальном столбце. Элементы соседних столбцов, которые как по своим химическим, так и по оптическим свойствам могут считаться гомологами, соединены прямыми линиями. Ряды следующих друг за другом элементов, которые отличаются тем, что у них идёт образование внутренних групп, заключены в прямоугольные рамки.
1 Ср.: N. Bohr. Drei Aufsätze über Spektren und Atombau. S. 132, Fig. 5 (см. рис. 4 на стр. 364 наст, изд.—Ред.), где можно найти обстоятельное пояснение к этому рисунку. Ни схема, ни рисунок названной в добавлении к этим статьям заметки Довийе (Dauvillier. Compt. Rend., 1922, Mai), касающейся наблюдения некоторых слабых линий рентгеновского спектра элемента с атомным номером 72 в смеси редких земель, не должны приниматься во внимание, так как это наблюдение вряд ли может считаться достоверным. Существование элемента между Lu (71), высшая валентность которого 3, и Та (73), высшая валентность которого 5, с химическими свойствами, подобными Lu, было бы отклонением от общего правила, что при переходе от одного элемента к следующему высшая валентность никогда не увеличивается больше, чем на единицу; это правило имеет непосредственное объяснение в общепринятых представлениях о строении атома (ср. в этой связи: С. R. Bury. Jour. Am. Chem. Soc., 1921, 43, 1902).
Построение табл. 1 базируется в основных чертах на общих рассуждениях, изложенных в указанной выше работе. При разработке деталей существенную роль играет обстоятельный анализ спектральных серий. Хотя в этих спектрах ясно отражается и постепенное образование внутренних электронных групп, непосредственные сведения, которые можно почерпнуть из этих спектров, относятся в первую очередь к постепенному появлению тех новых типов электронных орбит, с которых начинается образование новой ступени. В соответствии с этим в табл. 1 (см. стр. 443) даны только те элементы, которыми начинаются такие ступени. Во всех остальных случаях, где спектроскопический материал недостаточен для однозначного вывода о числе электронов во внешних группах, числа электронов, соответствующих более высоким квантовым числам, заключены в скобки. Дальнейшее образование групп указано только его конечным результатом; даже в описании окончательно образовавшихся групп пока остаётся много сомнительного, особенно в отношении более тонкого взаимодействия электронных движений внутри одной и той же главной группы и её подгрупп. Не входя здесь в детали, мы хотим только указать на то, что введённые в названной выше работе общие предположении о характере этого взаимодействия, как там подробнее указано, на основе принципа соответствия представляют исходный пункт для теоретического понимания типичных законов, регулирующих спектры испускания и пoглощения в рентгеновской области. Основные черты этих законов выяснены в формальной теории Косселя.