Переходя от натрия к другим элементам третьего периода системы элементов, мы имеем при связывании 12-го, 13-го и 14-го электронов отношения, совершенно аналогичные тем, с которыми мы встретились при рассмотрении связывания 4-го, 5-го и 6-го электронов. Можно предполагать, что в нейтральном атоме кремния имеется конфигурация электронов, в которой четыре последних присоединённых электрона движутся по 31-орбитам; эти орбиты, подобно 21-орбитам в атоме углерода, образуют столь симметричную конфигурацию, что присоединение нового электрона (в атомах следующих элементов) на 31-орбиту невозможно. 15-й электрон у элементов с более высоким атомным номером будет захватываться поэтому на орбиту нового типа. Однако в отличие от случая присоединения 7-го электрона здесь орбита не будет круговой, но эксцентрической вращающейся орбитой типа 32. Это тесно связано с тем обстоятельством, что эксцентрическая орбита соответствует большей прочности связи электрона, чем круговая с тем же главным квантовым числом: в первом случае электрон в некоторые промежутки времени будет проникать глубоко внутрь атома. Правда, 32-орбита не будет достигать областей внутренних 11-орбит; однако она может приближаться к ядру на расстояния, значительно меньшие, чем радиусы круговых 22-орбит. Для 16-го, 17-го и 18-го электронов отношения такие же, как и для 15-го. Поэтому для атома аргона мы можем ожидать конфигурацию, в которой 10 внутренних электронов движутся по орбитам того же типа, как и в атоме неона; восемь последних электронов движутся по четырем З1- и четырем 32-орбитам, причём можно предполагать, что отношения симметрии соответствуют конфигурации двухквантовых орбит атома неона. Такое представление делает понятным качественное сходство в свойствах неона и аргона, а также элементов в других частях второго и третьего периодов; одновременно оно открывает возможность естественного объяснения важных количественных различий в свойствах этих химических гомологов.
Переходя к четвертому периоду системы элементов, мы встречаем сначала вещества, аналогичные в химическом отношении элементам начала двух предыдущих периодов. Этот факт находится в согласии с тем, что можно было ожидать заранее. Мы представляем себе, что 19-й электрон связывается на орбите нового типа — 41. Отношения, на которые мы указывали при рассмотрении присоединения 11-го электрона в атоме натрия, выступают здесь ещё резче вследствие больших значений квантовых чисел, определяющих орбиты внутренних электронов. Внутренняя петля 41-орбиты почти совпадает с 31-орбитой; поэтому размеры внешних частей орбиты 19-го электрона атома калия не только сильно отличаются от размеров 41-орбиты атома водорода, но, как этого следует ожидать, почти совпадают с размерами водородной орбиты типа 21 приблизительно вчетверо меньшими размеров орбиты 41. Этот результат даёт возможность сразу учесть основные черты спектральных и химических свойств калия. Подобные же результаты получаются для кальция, нейтральный атом которого содержит два валентных электрона на 41-орбитах. Однако элементы более высоких атомных номеров четвертого периода, как известно, всё более отличаются от соответствующих элементов третьего периода. Семейство металлов группы железа уже существенно отлично по свойствам от элементов предыдущего периода. Переходя к ещё более высоким атомным номерам, мы встречаемся с рядом веществ, снова приближающихся в химическом отношении к элементам последней части предыдущего периода; атомному номеру 36 соответствует снова благородный газ криптон.
Эти соотношения соответствуют нашим ожиданиям. При рассмотрении образования и устойчивости электронных конфигураций атомов трёх первых периодов мы основывались на том, что каждый из 18 первых электронов в следующем элементе связан на орбите с тем же главным квантовым числом. Как легко видеть, это уже неверно в отношении 19-го электрона. С возрастанием заряда ядра и связанным с этим уменьшением разницы силовых полей внутри и вне области орбит 18 первых связанных электронов размеры той части 41-орбиты, которая расположена вне области внутренней конфигурации, всё больше приближаются к размерам четырёхквантовой орбиты, рассчитанной без учёта взаимодействий электронов атома. С возрастанием атомного номера настаёт, наконец, момент, когда 33-орбита соответствует более сильной связи 19-го электрона, чем 41-орбита. Это происходит в самом начале четвертого периода.
Излучение спектра калия непосредственно показывает, что 41-орбита соответствует связи, вдвое более сильной, чем связь на орбите 33, относящейся к первым спектральным термам 𝐷-ряда. У кальция дело обстоит совершенно иначе. Здесь мы должны рассматривать не дуговой спектр, соответствующий связыванию 20-го электрона, а искровой спектр, отвечающий присоединению 19-го электрона. Искровой спектр магния весьма похож в отношении спектральных термов различных рядов на спектр натрия — только постоянная в формуле (12) вчетверо больше постоянной Ридберга. Но в искровом спектре кальция мы встречаем своеобразные особенности: первый терм 𝐷-серии больше, чем первый терм 𝑃-серии, и только немного меньше, чем первый терм 𝑆-серии, соответствующий связыванию 19-го электрона в нормальном состоянии. Это иллюстрируется на рис. 3, схематически изображающем стационарные состояния натрия и калия по дуговым спектрам и магния и кальция по искровым спектрам. Так же, как и на рис. 1 и 2 для спектра натрия, и в данном случае при выбранном масштабе мультиплетность термов не могла быть отмечена, и числа около стационарных состояний относятся только к квантовым числам 𝑛 и 𝑘. Для сравнения масштаб, в котором нанесена энергия различных состояний, взят для искровых спектров вчетверо меньше, чем для дуговых. Таким образом, перпендикулярные линии, обозначенные различными значениями 𝑛, соответствуют в дуговых спектрах термам спектра водорода, а в искровых — термам искрового спектра гелия. Если мы проследим на схеме изменение относительной силы связи 19-го электрона в 41- и 33-орбитах от калия до кальция, то увидим, что нужно быть готовым к тому, что в следующем элементе — скандии — 33-орбита будет соответствовать более прочной связи 19-го электрона, чем 41-орбита. Но и на 33-орбите связь 19-го электрона в атоме будет слабее, чем связь первых 18 электронов, как это ясно из предыдущего; это согласуется с электроположительными свойствами скандия в химических соединениях, где он выступает трёхвалентным.
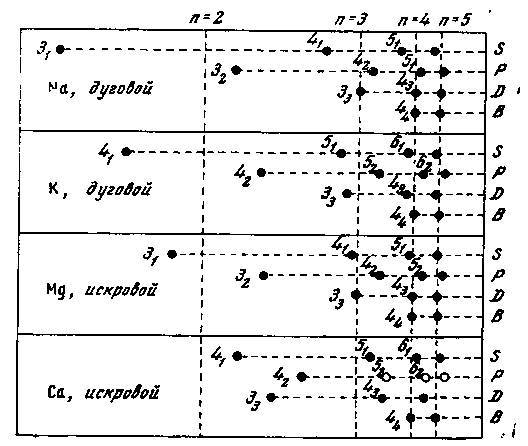
Рис. 3
В следующих элементах в нормальном состоянии атома появится большее число электронов на 33-орбите; число таких орбит будет зависеть от прочности связи электронов на них по сравнению с прочностью на 41-орбите, на которой во всяком случае движется последний присоединённый электрон. В отношении образования и прочности атомов мы встречаемся здесь с соотношениями, существенно отличными от тех, которые нами рассмотрены в предыдущих периодах системы элементов. В отличие от прежнего с возрастанием атомного номера мы имеем дело с образованием одной из внутренних электронных групп атома, в нашем случае группы электронов на трёхквантовых орбитах. Только в том случае, когда образование такой группы завершается, мы можем с возрастанием атомного номера ожидать изменения в свойствах элементов, подобного тому, с которым мы встречались в предыдущих периодах. Анализ свойств элементов последней части четвертого периода показывает непосредственно, что соответствующая группа в её завершённой форме должна содержать 18 электронов; мы должны думать, например, что криптон, кроме групп одноквантовых, двухквантовых и трёхквантовых орбит, имеет симметричную конфигурацию из 8 электронов в четырёхквантовых орбитах (четыре 41-орбиты и четыре 42-орбиты).