При нагревании С. взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800—900 °С пары С. реагируют с углеродом, образуя сероуглерод CS2. Соединения С. с азотом (N4S4 и N2S5) могут быть получены только косвенным путём.
Получение. Элементарную С. получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. О способах добычи С. см. Серные руды. Источник сернистого водорода для производства С. — коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие: 1) H2S извлекают из газов раствором моногидротиоарсената натрия:
Na2HAsS2 + H2S = Na2HAsS3O + H2O.
Затем продувкой воздуха через раствор осаждают С. в свободном виде:
NaHAsS3O + 1/2 O2 = Na2HAsS2O2 + S.
2) H2S выделяют из газов в концентрированном виде. Затем его основная масса окисляется кислородом воздуха до С. и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
2H2S + SO2 = 3S + 2H2O.
В основе получения С. из SO2 лежит реакция восстановления его углём или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
В 1972 элементарной С. в мире (без социалистических стран) произведено 32,0 млн. т; основная масса её добывалась из природных самородных руд. В 70-е гг. 20 в. первостепенное значение (в связи с открытием крупных месторождений сероводородсодержащих топливных газов) приобретают методы получения С. из H2S.
Сорта С. Выплавленная непосредственно из серных руд С. называется природной комовой; полученная из H2S и SO2 — газовой комовой. Природная комовая С., очищенная перегонкой, называется рафинированной. Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы — черенковой С. При конденсации С. ниже точки плавления на стенках конденсационных камер образуется мелкий порошок С. — серный цвет. Особо высокодисперсная С. носит название коллоидной.
Применение. С. применяется в первую очередь для получения серной кислоты: в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения чёрного (охотничьего) пороха; в производстве спичек.
И. К. Малина.
В медицинской практике применение С. основано на её способности при взаимодействии с органическими веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. kéras — рог и lytikós — растворяющий), противомикробные и противопаразитарные эффекты. С. входит в состав Вилькинсона мази и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную С. употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и др.); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и др.
Сера в организме. В виде органических и неорганических соединений С. постоянно присутствует во всех живых организмах и является важным биогенным элементом. Её среднее содержание в расчёте на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5—2%, наземных — 0,5%. Биологическая роль С. определяется тем, что она входит в состав широко распространённых в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и другие Сульфгидрильные группы (— SH) остатков цистеина играют важную роль в структуре и каталитическая активности многих ферментов. Образуя дисульфидные связи (— S — S —) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных С. обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в жёлчи), гепарина, таурина. В некоторых железосодержащих белках (например, ферродоксинах) С. обнаружена в форме кислотолабильного сульфида. С. способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения С. в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче). Морские организмы богаче неорганическими соединениями С., чем пресноводные и наземные. Для растений и многих микроорганизмов сульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения С. претерпевает изменения в валентности и превращается затем в органическую форму в своём наименее окисленном состоянии; т. о. С. широко участвует в окислительно-восстановительных реакциях в клетках. В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат:
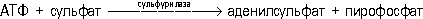
Катализирующий эту реакцию фермент — сульфурилаза (АТФ: сульфат — адснилилтрансфераза) широко распространён в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на др. акцептор или восстанавливается.
Животные усваивают С. в составе органических соединений. Автотрофные организмы получают всю С., содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов. Способностью к автотрофному усвоению С. обладают высшие растения, многие водоросли, грибы и бактерии. (Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.) Большую роль в круговороте С. в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения С. — биогенного происхождения. С. входит в состав антибиотиков (пенициллины, цефалоспорины); её соединения используются в качестве радиозащитных средств, средств защиты растений.
Л. И. Беленький.
Лит.: Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Природная сера, под ред. М. А. Менковского, М., 1972; Некрасов Б. В., Основы обшей химии, 3 изд., т. 1, М., 1973; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Янг Л., Моу Д ж., Метаболизм соединений серы, пер. с англ., М., 1961; Горизонты биохимии, пер. с англ., М., 1964; Биохимия растений, пер. с англ., М., 1968, гл. 19; Торчинский Ю. М., Сульфгидрильные и дисульфидные группы белков, М., 1971; Дегли С., Никольсон Д., Метаболические пути, пер. с англ., М., 1973.
Сёра Жорж Пьер
Сёра' (Seurat) Жорж Пьер (2.12.1859, Париж, — 29.3.1891, там же), французский живописец и график, основатель и лидер неоимпрессионизма (дивизионизма, пуантилизма). Учился в Париже в Школе изящных искусств (1878—79). Писал большие фигурные композиции и пейзажи. Изучая законы цвета и света, оптические эффекты, С. пытался создать научную основу для решения колористических, свето-воздушных и пространственных задач. Изящная по рисунку, тонкая по цветовым сочетаниям, живопись С., с её мозаически-дробной структурой, в целом носит несколько рассудочный, отвлечённый характер («Воскресная прогулка на острове Гранд-Жатт»). Для работ С. (особенно последних, близких к стилистике «модерна») характерно также тяготение к масштабам и возможностям монументальной живописи («Цирк», 1890—91, Музей импрессионизма, Париж).