Британские власти всячески препятствовали распространению паровых автомобилей и инженерным работам по их усовершенствованию.
Сходной позиции придерживались и прочие правительства во всем мире, хотя сегодня ясно, что паровой транспорт экологически чистый и безопасный. Помощниками правительств в начале XX столетия стали автомобильные магнаты — компании «Форд», «Олдс» и др. После того как паровой автомобиль победил на гонках во Флориде (США) в 1906 г., монополисты поняли, что проиграют в этой конкуренции. Паровой автомобиль развил скорость 205 км/ч, о чем в те времена не могли мечтать разработчики бензиновых двигателей.
Что касается бензинового двигателя, то он был изобретен только в 1868 г. французом Авелем. Судьба этого устройства интересна.
Когда закончились конструкторские работы по созданию «газолиновой повозки», как ее окрестили историки, началась франко-прусская война. Изобретатель, желая скрыть свое детище от прусской армии, зарыл повозку в защитный насыпной вал, перекрывавший неприятелю подступы к Парижу. После расчистки вала автомобиль обнаружить так и не удалось.
В течение длительного времени разработки в данном направлении не велись, и только расцвет нефтяной промышленности привлек внимание к газолиновым устройствам. Газовый четырехтактный двигатель внутреннего сгорания был впервые построен спустя 10 лет после машины Авеля. Автором проекта выступил в 1878 г. немецкий изобретатель Н. Отто.
Законы газов
Учение о теплоте успешно развивалось во многом благодаря прогрессу в ряде остальных физических наук. Фундамент теоретических и практических знаний ученых и изобретателей XVII–XIX вв. опирается на положения о способности водяного пара совершать работу и о молекулярном строении вещества. Однако эти положения и сами должны иметь некий базис. Таковой возник после открытия давления воздуха, а впоследствии дополнился изучением свойств газообразных веществ. Механика и кинетическая теория газов, бурно развивавшиеся с середины XVII в., обогатили представления физиков о процессах в системах молекул и способствовали разработке замечательных технических изобретений.
Открытие параметров газа
Термин «газ» ввел голландский химик Я. Ван-Гельмонт для обозначения всех веществ, пребывающих в газообразном состоянии. Это слово происходит от древнегреческого «хаос», которое имеет два значения — беспорядок и сияющее пространство. Ван-Гельмонт выбрал, в чем он сам впоследствии признавался, последний вариант. Тем самым химик намеревался уже в самом названии показать, что газ «ничем не отличается от хаоса древних».
Сегодня физикам известно, что для описания газа вполне подходят оба значения слова «хаос», потому что молекулы газа находятся в крайне беспорядочном состоянии. И все же мы всегда имеем дело с газом как сколько-нибудь упорядоченной физической системой. Дело в том, что подлинный беспорядок в газе возникает лишь во время рассеивания его в мировом пространстве.
Огромные, растянувшиеся подчас на сотни миллиардов километров туманные скопления холодного газа во Вселенной расширяются во всех направлениях, встречая лишь слабое сопротивление космической среды, а именно одиночных частиц и излучения. Молекулы и атомы расходятся по разным направлениям. Лишь конечность скорости препятствует стремительному рассасыванию газовых туманностей.
На Земле и других планетах газ пребывает в более или менее упорядоченном состоянии. Во-первых, благодаря силе тяжести, действующей на все без исключения планетные тела, газ здесь обладает весом. Далее (о чем уже сообщалось в разделе о давлении воздуха) в замкнутом пространстве газообразное вещество приобретает давление. Если в мировом пространстве значительно разреженные туманности не обладают реальной температурой, то газы в ограниченном объеме способны аккумулировать лучистую энергию солнца.
Температура, в свою очередь, влияет на давление. Например, земной воздух от неоднородного нагрева становится легче в одной местности и вытесняется более прохладным и тяжелым, поступающим из соседних регионов. Перемещения легких и тяжелых масс связаны с неравномерным распределением воздушного давления и порождают потому ветер и перемены погоды. Воспетые романтиками морские бризы являют собой типичный пример замены воздушных теплых и холодных масс на границе суши и моря в течение суток.
Не менее часто случается наблюдать и другой процесс. Знаете ли вы, отчего на больших высотах воздух холоден, хотя он там ближе к потоку солнечной энергии? Солнце не нагревает воздух напрямую, он получает солнечное тепло, отраженное землей или отданное океаном. Поэтому теплые массы воздуха скапливаются в приземном слое. Они легче, чем вышележащие холодные массы, а потому постепенно вытесняются ими. Легкий воздух вытесняется тяжелым вверх, расширяется в высших слоях атмосферы, где пространство больше, и оттого остывает.
Таким образом, система газообразного тела обладает еще одним параметром — объемом, который тесно связан с температурой и давлением. Плодотворно изучать свойства газов оказалось возможным лишь после того, как физики пришли к представлению о существовании трех названных параметров и вывели т. н. газовые законы. Эти законы провозглашают взаимосвязь между различными параметрами. Короткий рассказ о земной атмосфере и происходящих в ней явлениях убеждает, сколь разнообразны подобные взаимосвязи и как необходимо их изучение для познания физики газов.
Открытие атмосферного давления в середине XVII в. послужило отправной точкой для начала глубоких, всесторонних исследований свойств газа. Эти исследования были обусловлены также растущими нуждами промышленности, которая нуждалась в химическом производстве, а в дальнейшем начала использовать силу пара в тепловых машинах. Уже в XVII столетии был открыт один из классических газовых законов, вошедший во все учебники физики. Его авторами были англичанин P. Бойль и француз Э. Мариотт, которые почти одновременно и независимо друг от друга пришли к открытию этого закона.
Закон Бойля-Мариотта касается изменяющихся параметров газа постоянной массы, как, впрочем, и все остальные газовые законы. Масса должна быть постоянной, поскольку это означает неизменное количество молекул. Бойль и Мариотт проводили в целом сходные опыты, не имевшие принципиальных отличий. В частности, Бойль использовал изогнутую стеклянную трубку, которую заполнял ртутью через ее открытый конец, тогда как второй был запаян. Изгиб делил трубку на два неравных колена — длинное с открытым концом и короткое с запаянным концом.
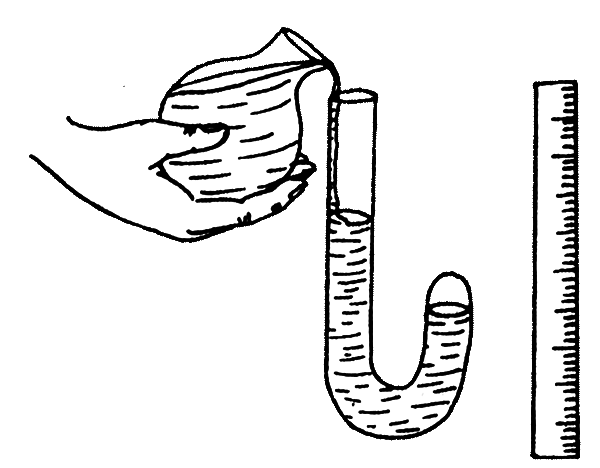
По мере прибавления ртути в длинном колене жидкий металл оказывал все большее давление на воздух, который оказался «запертым» в коротком колене с запаянным концом. Поэтому Бойль имел возможность наблюдать процесс сжатия воздуха по мере возрастания давления. Рассчитать давление было нетрудно, поскольку объем добавленной в трубку ртути был ученому прекрасно известен. Измерения показали, что при неизменной температуре изменение давления обратно пропорционально изменению объема.
Закон Бойля-Мариотта имеет любопытные следствия. Например, этот закон гласит, что скорость истечения газа из емкости не зависит от давления этого газа. Внешнее давление, если оно меняется, будет оказывать влияние на истечение газовой струи, но никак не на собственное. Истечение газа в вакуум полностью подтверждает справедливость этого утверждения. Сжатый газ при любой силе сжатия вытекает с одинаковой скоростью. Причиной тому является взаимосвязь газовых параметров. Так как объем обратно пропорционален давлению, то плотность газа (масса на объем) прямо пропорциональна давлению.
Получается, что стоит сжать газ с большей силой, как пропорционально возрастает плотность и масса вещества истекающей струи. Масса и сила связаны по второму закону Ньютона. Их отношение дает ускорение. Поскольку масса и сила изменяются пропорционально друг другу, ускорение останется неизменным. А значит, и скорость струи газа не увеличится. Другим удивительным следствием газового закона является то, что он зачастую не соблюдается.