6.2.4 Нормативные требования
Медицинские изделия подпадают под действие нормативных актов, национальных стандартов. Необходимо понимать, какие именно правила и стандарты будут применяться. Это особенно важно во время разработки изделия, потому что способ выполнения проекта может иметь отношение к тому, какие правила или стандарты применяются или какие утверждения изделия могут потребоваться.
Пример 1. Стандарты7, которые могут быть применимы к изделию «Томограф компьютерный»:
– ГОСТ Р МЭК 60601-1-2010 «Изделия медицинские электрические. Часть 1. Общие требования безопасности с учетом основных функциональных характеристик»;
– ГОСТ Р МЭК 60601-1-2-2014 «Изделия медицинские электрические. Часть 1-2. Общие требования безопасности с учетом основных функциональных характеристик. Параллельный стандарт. Электромагнитная совместимость. Требования и испытания»;
– ГОСТ Р МЭК 60601-1-3-2013 «Изделия медицинские электрические. Часть 1-3. Общие требования безопасности с учетом основных функциональных характеристик. Дополнительный стандарт. Защита от излучения в диагностических рентгеновских аппаратах»;
– ГОСТ Р МЭК 60601-2-28-2013 «Изделия медицинские электрические. Часть 2-28. Частные требования безопасности с учетом основных функциональных характеристик медицинских диагностических рентгеновских излучателей»;
– ГОСТ Р МЭК 60601-2-44-2013 «Изделия медицинские электрические. Часть 2-44. Частные требования безопасности с учетом основных функциональных характеристик к рентгеновским компьютерным томографам»;
– ГОСТ IEC 60825-1-2013 «Безопасность лазерной аппаратуры. Часть 1. Классификация оборудования, требования и руководство для пользователей»;
– ГОСТ Р МЭК 62304-2013 «Изделия медицинские. Программное обеспечение. Процессы жизненного цикла»;
– ГОСТ ISO 10993-1-2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования».
Пример 2. Стандарты, которые могут быть применимы к изделию «Набор реагентов для количественного определения ферритина в сыворотке и плазме»:
– ISO 18113-1 «Изделия медицинские для диагностики in vitro. Информация, представленная заводом-изготовителем (маркировки) – Часть 1: термины, определения и общие требования»;
– ISO 18113-2 «Изделия медицинские для диагностики in vitro. Информация, представленная заводом-изготовителем (маркировки) – Часть 2: Диагностические реагенты In vitro для профессионального использования»;
– ISO I5223-1 «Медицинские изделия – символы, использующиеся с медицинским изделием, этикетки, маркировки и предоставляемая информация – Часть 1: общие требования»;
– ISO 13485 «Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования»;
– EN 13612 «Оценка эффективности медицинских изделий для диагностики in vitro»;
– EN 62366 «Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности»;
– ISO 23640 «Тестирование на стабильность диагностических реагентов in vitro»;
– EN 13641 «Устранение или снижение риска инфицирования, связанного с применением медицинских изделий для in vitro диагностики»;
– EN 13975 «Методики выборочного исследования для приемочных испытаний медицинских изделий для диагностики in vitro»;
– ISO 14971 «Изделия медицинские. Применение менеджмента риска к медицинским изделиям».
Таким образом, включение нормативных требований в спецификацию важно для успеха и признания изделия на рынке.
6.3 Определение критериев спецификации дизайна изделия
6.3.1 Обзор критериев, которые необходимо выбрать
Идентификация критериев неизбежно повторяется по мере того, как становится доступно больше информации и принимаются решения о потребностях пользователей, проектных решениях, деталях дизайна и способах производства изделия. Наиболее экономичный подход – сконцентрироваться на сборе конкретной информации, необходимой для принятия немедленных решений. Со временем больше критериев могут быть включены. Приоритизация критериев и получение правильных значений – это повторяющийся процесс на ранних этапах проектирования изделия.
В случае компромиссов, противоречащих друг другу требований или необходимости приоритизации вопросов использование развертывания функции качества (QFD) может быть полезным инструментом для помощи в принятии решений (см. внимание ниже).
QFD (Развертывание функции качества) – это методология, которая возникла на верфи Mitsubishi в Кобе в Японии, а затем была разработана и расширена компанией Toyota и ее поставщиками. Впоследствии его подхватили крупные американские производители автомобилей и другие ведущие компании в разных секторах, особенно в области электроники.
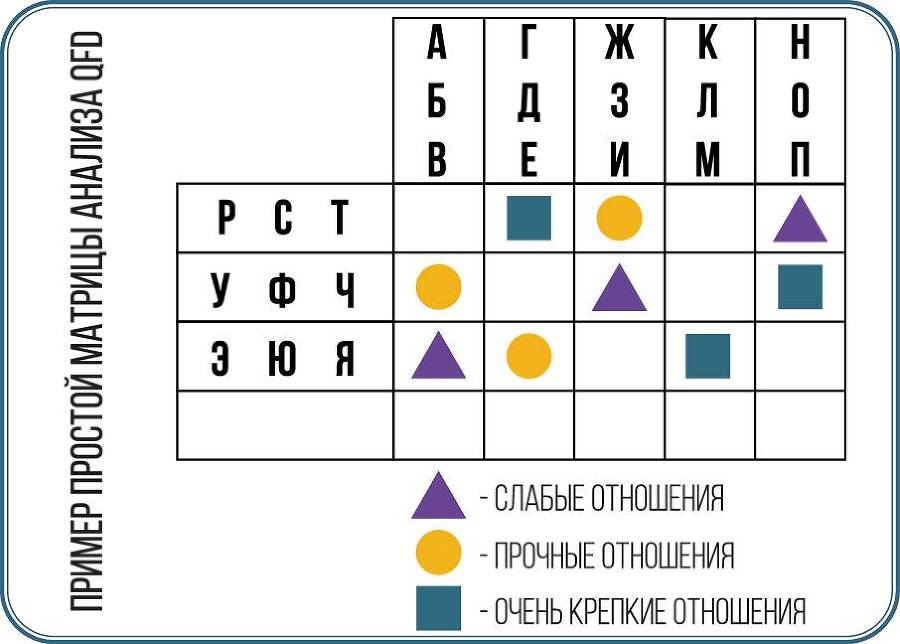
QFD – это инструмент, который помогает в разработке изделия/процесса от стадии концепции до его производства и далее. QFD особенно полезен для выявления критических требований заказчика и создания конкретных связей между этими требованиями и параметрами проекта. Метод использует матрицы для организации информации и помогает различным заинтересованным сторонам согласовать критические параметры и компромиссы. На рисунке в данном блоке показан типичный пример простой матрицы. Степень его использования будет зависеть от размера и сложности продукта/процесса. Это метод, который требует времени для освоения, но при правильном применении может принести существенные преимущества с точки зрения доли рынка, более конкурентоспособного продукта/процесса и обеспечения внесения изменений в конструкцию до начала производства или его изготовления, а не после.
Использование QFD при проектировании изделия/процесса может потребовать значительных затрат на начальном этапе с точки зрения времени, денег и персонала, которые уменьшаются по мере продвижения проектирования. Это контрастирует с более традиционным использованием ресурсов, которое начинается скромно и достигает пика по мере приближения к завершению проектирования. Как только команда освоит его использование, QFD-подход получит преимущества по сравнению с более традиционным подходом к проектированию изделия. Для тех, кто использует QFD впервые и/ или если сложное изделие, возможно, стоит подумать о привлечении эксперта в QFD для подготовки рекомендаций и советов.
QFD часто используется в сочетании с другими методами, такими как методы Тагути и принципы работы «точно в срок/всеобщее управление качеством» (JIT/TQM).
Одним из основных преимуществ QFD является практическое устранение изменений в работе, которые часто происходят на этапе проектирования/разработки, к тому времени, когда должно начаться производство. Более подробно мы рассмотрим эту методологию в следующих главах.
Важно учитывать весь жизненный цикл изделия, а не только концентрироваться на эксплуатации пользователем. Это означает, что нужно думать о рынке, разработке изделия, производстве, упаковке, распространении, использовании, обучении, техническом обслуживании, ремонте, повторном использовании, переработке, утилизации и о том, как каждый из этих этапов может повлиять на конструкцию (рисунок 6.1).
Рисунок 6.1 – Этапы идентификации критериев изделия