(4.26)
которому, однако, нельзя сопоставить потенциал ионизации или иную наблюдаемую характеристику молекулы.
Следует отметить также тесную связь понятий локализации МО и гибридизации АО, которую иллюстрирует рассмотренный выше пример. Гибридизация АО должна обеспечивать представление локализованных молекулярных орбиталей минимальным числом базисных гибридных атомных орбиталей. В свою очередь каждая гибридная АО должна участвовать в минимальном числе локализованных МО.
Как правило, построение локализованных МО из одних лишь соображений симметрии не является возможным и необходимо привлечение дополнительных критериев и определенной методики локализации. К настоящему времени разработано несколько методов преобразования канонических МО, найденных тем или иным путем, в МО, локализованные на отдельных атомах и связях. Некоторые из этих методов мы рассмотрим ниже.
Методы Эдмистона-Рюденберга и Бойса. В методе, предложенном Эдмистоном и Рюденбергом [38], определяются ор-битали самосогласованного поля, которые отделены друг от друга насколько это возможно, хотя на них заранее не накладывается условие определенной локализации в пространстве или на отдельных атомах и связях.
Среднее межорбитальное разделение характеризуется суммой кулоновских двухэлектронных интегралов:
(4.27)
причем унитарное преобразование локализации
(4.28)
должно обеспечивать минимальность величины J(2). В силу равенства
(4.29)
и инвариантности первой суммы в правой части этого равенства относительно преобразования (4.28) минимум величины J(2) соответствует максимуму
(4.30)
J(1) характеризует в среднем плотность орбиталей fi в смысле интеграла
(4.31)
определяющего энергию отталкивания двух электронов, находящихся в одном и том же i-м одноэлектронном состоянии, заданном орбиталью fi. Из равенства
(4.32)
и инвариантности
следует далее, что минимум J
(2) и максимум J
(1) обеспечивают минимальное значение суммы обменных двухэлектронных интегралов:
(4.33)
На возможность использования энергии обменного взаимодействия К в качестве критерия локализации МО указывали Леннард-Джонс и Попл. Минимизация К позволяет максимально приблизить выражение для энергии электронного взаимодействия к виду, соответствующему аппроксимации многоэлектронной функции простым произведением спин-орбиталей. В этом случае каждому электрону, точнее каждой паре электронов, можно приписать определенную локализованную орбиталь. Такое соответствие между электронами и орбиталями нарушается при антисимметризации N-электронной функции-произведения, т. е при учете неразличимости электронов и связанной с ней антисимметричностью точной многоэлектронной функции относительно перестановок электронов.
Об уменьшении при локализации МО обменной энергии электронного взаимодействия, а также об увеличении J(1) и уменьшении J(2) по сравнению со значениями, соответствующими каноническим МО, можно судить по данным табл. 4, полученным в работе [82] для гидридов бора.
Таблица 4. J(1), J(2) и K для исходных канонических и локализованных МО
В табл. 5 приведены результаты Эдмистона и Рюденберга по локализации МО в молекулах N2, СО и BF. Первая из этих молекул характеризуется симметрией D∞h, гетеронуклеарные СО и BF — симметрией C∞ν. Их канонические МО должны поэтому классифицироваться на σ- и π-орбитали. Каждая из рассматриваемых изоэлектронных молекул содержит десять электронов в σ-системе и четыре — в π-системе. Четыре из десяти σ-электронов принадлежат атомным остовам в том смысле, что описываются МО (iA), локализованными на внутренних (остовных) σ-оболочках. Эти орбитали практически идентичны атомным 1s-орбиталям. Следующие четыре σ-электрона описываются локализованными МО (lА), представляющими неподеленные электронные пары атомов. Оставшиеся два электрона должны относиться, очевидно, к связывающей σ-орбитали. Однако локализация МО по методу Эдмистона и Рюденберга приводит к связывающим МО иной симметрии. Эти локализованные МО (bi) не могут быть отнесены ни к σ-, ни к π-типу. Они образуют систему трех эквивалентных, так называемых банановых МО, переводящихся друг в друга преобразованиями группы С3υ и определяемых с точностью до произвольного поворота относительно молекулярной оси. В ряду молекул N2, CO, BF характер трех эквивалентных связывающих МО bi монотонно меняется от строго ковалентного для N2 до существенно поляризованного в направлении атома фтора для молекулы BF. В последнем случае они подобны неподеленным парам атома фтора.
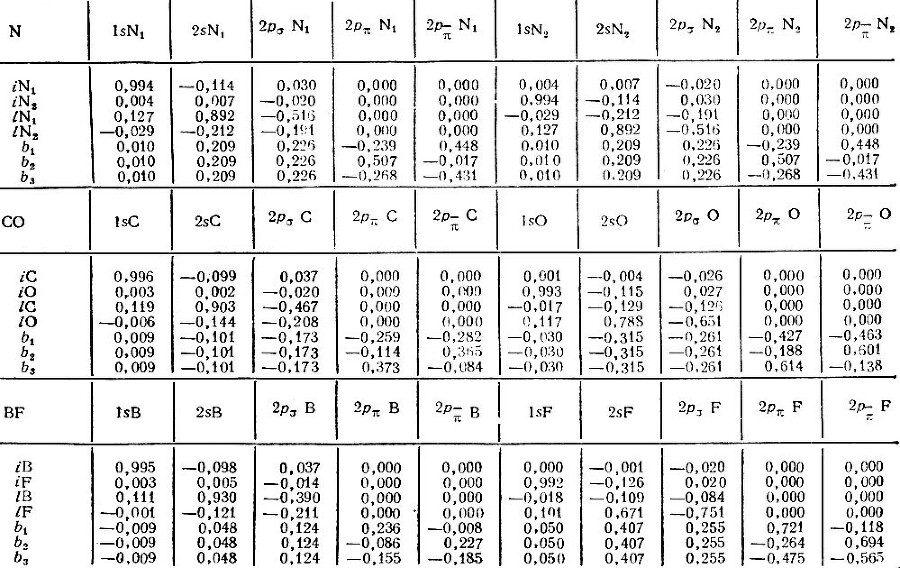
Таблица 5. Орбитали Эдмистона-Рюденберга в молекулах N2, CO и BF
Практическая реализация метода Эдмистона-Рюденберга предполагает использование формализма самосогласованного поля и вычисление большого числа двухэлектронных интегралов, что представляет довольно сложную математическую задачу. Количество таких интегралов, как и время, необходимое для максимизации J(1) (или минимизации J(2) и К), очень быстро растет с увеличением числа электронов в системе и числа базисных АО, используемых для представления МО.
Следует отметить также, что метод Эдмистона и Рюденберга, строго говоря, не гарантирует соответствия между локализованными МО и отдельными атомами или связями. Впрочем, это обстоятельство может рассматриваться не только как недостаток, но и как достоинство метода, поскольку он допускает в принципе представление МО в базисе, существенно отличающемся от многоцентрового базиса АО.
В вычислительном отношении более удобным, чем метод Эдмистона-Рюденберга, является метод Бойса [31]. В качестве критерия, определяющего степень локализации МО, в этом методе используется сумма квадратов расстояний (Ri) между центрами тяжести орбиталей:
(4.34)
где
(4.35)
Локализованные по Бойсу МО характеризуются максимальным разделением в пространстве по критерию В и одновременно минимальными среднеквадратическими радиусами, точнее минимальным значением суммы их квадратов:
(4.36)
Недостатком метода Бойса является то, что он не обеспечивает эффективного разделения валентных и остовных АО. Например, 1s- и 2s-орбитали сферически-симметричны и никаким преобразованием нельзя изменить расстояния между их центрами тяжести (которое всегда равно нулю). С другой стороны, смешение остовной 1s-орбитали с валентными np-орбиталями должно приводить к увеличению расстояния от нулевого до некоторого конечного (для гибридных АО) значения. Максимуму значения В при этом должна соответствовать тетраэдрическая гибридизация 1s- и nр-АО. В действительности наряду с остовной 1s-орбиталью следует принимать во внимание и валентную ns-AO. Именно она должна смешиваться с другими валентными АО. Но с учетом сказанного выше ясно, что метод Бойса может приводить к завышенному вкладу остовных АО в связывающие МО.