1. Двухэлектронная связь образуется при взаимодействии неспаренных атомных электронов.
2. Образование связи сопровождается спариванием спиновых моментов отдельных электронов.
3. Спаренные электроны некоторой связи не могут одновременно принадлежать другим связям.
4. Для двухэлектронной связи определяющими являются те резонансные интегралы, которые включают лишь по одной атомной орбитали от каждого атома.
5. Из двух атомных орбиталей с одинаковой зависимостью более прочную связь образует та, амплитуда которой в направлении связи больше. Для заданной атомной орбитали связь образуется в направлении ее ориентации.
6. Из двух атомных орбиталей с общей угловой зависимостью более прочную связь обеспечивает орбиталь с меньшим средним радиусом (соответствующая более низкому энергетическому уровню).
Далее Полинг рассматривает случай двух атомов A и B, связанных двухэлектронной связью. Он полагает для простоты, что все прочие электроны в системе спарены и представляют собой или неподеленные пары, или пары электронов, связывающие атомы A и В с другими атомами. При этом Полинг предлагает использовать в качестве атомных орбиталей не только сферические функции, характеризуемые квантовыми числами l и m, но и их линейные комбинации, т. е. гибридные атомные орбитали. "Допустим,- пишет Полинг,- что атом А представляет для образования связи несколько одноэлектронных собственных функций приблизительно одинаковой энергии и что изменение в энергии проникновения в остов (атома) (in energy of penetration info the core) пренебрежимо мало по сравнению с энергией связи. Тогда мы можем принять для одноэлектронных собственных функций следующее выражение[16]:
(3.45)
в котором
— численные коэффициенты, a
— определенный набор одноэлектронных собственных функций типа тех, которые получаются при разделении переменных в волновом уравнении в полярных координатах. Из функций ψ
n,lA, можно образовать такую группу функций, которая будет относиться к атому Лик связанным с ним атомам, кроме атома B, так что все электроны оказываются спаренными, кроме одного... Из орбиталей атома В можно образовать аналогичную группу с одним неспаренным электроном.
Тогда энергия взаимодействия двух групп может быть рассчитана с помощью вариационного принципа путем замены собственной функции молекулы на собственные функции этих двух групп так, чтобы при этом удовлетворялись требования симметрии" [72, с. 1369].
Иными словами, введенные Полингом гибридные орбитали должны определяться минимизацией полной энергии молекулы относительно коэффициентов
. Однако учитывая, что резонансные интегралы, определяющие в значительной степени полную энергию системы, тем больше, чем сильнее перекрываются соответствующие орбитали, Полинг предложил заменить вариационный критерий выбора гибридных АО более простым критерием их максимального перекрывания.
В частном случае, когда имеются s- и p-АО с одинаковыми и фиксированными радиальными функциями, перекрывание определяется исключительно угловой зависимостью атомных орбиталей. Эта угловая зависимость такова, что "р-электроны будут образовывать более прочные связи, чем s-электроны, причем связи, образованные р-электронами атома, ориентируются под прямыми углами относительно друг друга" [72, с. 1371]. Однако эти АО (s- и р-типа) могут быть преобразованы в гибридные орбитали, которые обеспечивают образование более прочных связей в определенных направлениях.
Таким образом, концепция гибридизации Полинга сводилась к предположению, что каждая гибридная атомная орбиталь ориентирована по определенной связи, т. е. ее угловая зависимость характеризуется максимальной амплитудой в направлении атома, связь с которым она обеспечивает. Следуя работе Гайтлера и Лондона, Полинг полагает, что взаимодействие между химически связанными атомами можно рассматривать как возмущение. Для учета последнего в случае вырождения энергетических уровней необходимо построение правильных функций нулевого приближения. Одна из этих функций соответствует наименьшей (отрицательной) энергии возмущения. Полинг предложил в качестве такой функции выбрать гибридную орбиталь,- ориентированную в направлении связи. В соответствии с теорией возмущений можно ожидать, что гибридизация будет тем более существенной, чем меньше разность энергий s- и р-АО по сравнению с энергией возмущения, обусловленной химическим взаимодействием. Вид гибридных орбиталей в некоторых случаях можно было определить из условий их ортонормированности и эквивалентности. Если бы 2s- и 2р-АО имели одинаковую радиальную зависимость
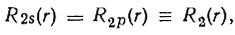
то гибридные АО имели бы вид
(3.46)
Именно такое представление гибридных АО и было дано Полингом (только в иных обозначениях). В действительности же радиальные атомные функции для разных значений квантового числа l различаются. Однако это обстоятельство не могло быть учтено в 30-х годах, хотя бы потому, что аналитические АО многоэлектронных атомов еще не были вычислены. Форму гибридной орбитали, точнее ее угловую зависимость, можно характеризовать полярной диаграммой:
(3.47)
Эта диаграмма может быть построена независимо от того, совпадают или нет радиальные функции, входящие в атомные орбитали. На рис. 18 приведены примеры этих диаграмм.
Рис. 18. Полярные диаграммы для spsub0/sub-гибридных АО углерода (одна из двух эквивалентных гибридных АО изображена сплошной линией, вторая — штриховой)
Теория гибридизации интенсивно обсуждается в современной литературе [22, 63, 73, 74, 88, 89], поэтому интерес к ней выходит за чисто исторические рамки. В связи с этим остановимся здесь на некоторых вопросах, связанных с попытками расширить первоначальную концепцию Полинга.
Вид гибридных орбиталей (т. е. коэффициенты гибридизации) при достаточно высокой симметрии окружения рассматриваемого атома может определяться из условий ортонормированности и эквивалентности гибридных орбиталей, как и в данном примере молекулы метана. В общем же случае необходимо привлечение дополнительных принципов, количественно определяющих коэффициенты гибридизации, таких, как, например, принцип максимального перекрывания. Согласно этому принципу, химическую связь образует пара сильно перекрывающихся гибридных атомных орбиталей, относящихся к соседним "непосредственно связанным" атомам в молекуле. Неподеленные электронные пары или вакантные орбитали описываются гибридными орбиталями либо неперекрывающимися, либо слабо перекрывающимися со всеми остальными АО как рассматриваемого, так и всех прочих атомов молекулы. Кроме того, по интегралам перекрывания для двух гибридных АО, обеспечивающих химическую связь атомов, можно судить о прочности этой связи, причем предполагается, что при отсутствии перекрывания атомных орбиталей образование химической связи невозможно.
При использовании принципа максимального перекрывания в его обобщенной формулировке, данной Малликеном в 1950 г., следует преобразовать орбитали каждого атома так, чтобы они, оставаясь ортогональными друг к другу, максимально (или минимально) перекрывались с АО других атомов, образующих молекулу[17]. Используя аналитические шестиэкспоненциальные функции Клементи, мы провели для примера расчеты гибридных орбиталей в молекулах NН3, Н2O и др. Для гидридов АНn (n < 4) орбитали атома А могут быть унитарно преобразованы таким образом, что выделяются отдельные гибридные АО, строго ортогональные ко всем остальным орбиталям атомов молекулы. Например, для молекулы аммиака полносимметричная гибридная АО азота