У гелия теплоёмкость в точке перехода (Рис. 182) тоже устремляется в бесконечность, создавая обычный для фазовых переходов пик [134]. Однако, пик этот уже слегка размыт, что говорит о растянутости самого фазового перехода, но перехода первого рода, сопровождаемого передачей теплоты! Её количество qравно площади S, заключённой под графиком теплоёмкости — в пределах узкой полосы температур в точке перехода (Рис. 182). Такие "размытые" фазовые переходы действительно существуют, особенно, — в сложных двухфазных, двухкомпонентных системах.
Рис. 182. Пик на графике теплоёмкости воды и гелия соответствует фазовому переходу, а его площадь S — скрытой теплоте q этого фазового перехода.
Так, в качестве возможной причины аномального поведения плотности воды возле точки плавления тоже называлось растянутое в широком температурном интервале плавление кристаллов льда (содержащего тяжёлые изотопы), взвешенных в воде [120]. Тем же, видно, обусловлена и другая аномалия воды. Её теплоёмкость с увеличением температуры не растёт, как у всех жидкостей, а падает, достигая минимума при 40 ºC, и лишь при дальнейшем нагреве начинает нарастать (считают, что это и задаёт стандарт температуры тела человека и всех теплокровных [138]). Аномально высокую теплоёмкость воды и её спад в диапазоне от 0 до 40 ºC тоже можно связать с плавлением кристаллов тяжёлого льда, для чего нужен подвод дополнительной теплоты плавления льда (80 кал/г). Причём, это избыточное количество теплоты 0,14 кал/г, находимое как площадь сегмента под левой ветвью кривой теплоёмкости (Рис. 183), в точности равно теплоте плавления заключённого в воде тяжелоизотопного льда. Содержащиеся в 1 г воды 0,0018 г тяжёлого льда H 2 18O, поглощают, по мере плавления, как раз 0,14 кал = (80 кал/г)×(0,0018 г). Выходит, у воды без тяжёлых изотопов нормальный ход имела бы и кривая плотности, и кривая теплоёмкости.
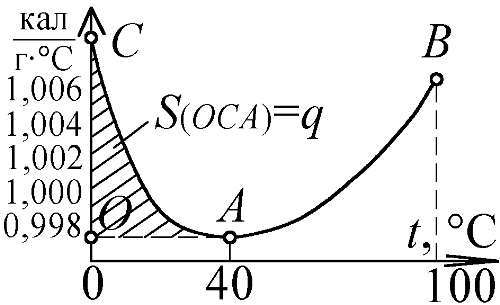
Рис. 183. Пик теплоёмкости С воды от плавления тяжёлого льда.
Интересно, что воду со сверхтекучим гелием роднит как раз очень редкое свойство уменьшать объём при нагревании. Заметим, что природный гелий тоже содержит изотоп, но, в отличие от воды, не тяжёлый, а лёгкий — 3He в количестве от 10 –4до 10 –8%.
Итак, переход гелия в сверхтекучее состояние вполне может быть простым фазовым переходом с отнятием тепла. Вероятно, одноатомный гелий при низкой температуре образует двух- и многоатомные молекулы He 2и He n . Причём, это состояние многоатомного газа ниже Т=2,17 К оказывается энергетически более выгодным, чем одноатомной жидкости, и, потому, гелий снова становится газом. Вот почему, превращаясь из жидкости в газ, гелий не поглощает, а выделяет тепло, которое надо отводить. И, точно, одиночка гелий иногда всё же образует двухатомные молекулы. Так, в разрядах удалось выявить ионы He 2 +. Да и переход 3He в сверхтекучее состояние, как считают, возможен лишь при слиянии его атомов в пары, словно электронов в сверхпроводнике [134].
Но, скорее, атомы гелия соединяются даже не в пары, а образуют гигантские комплексы, насчитывающие тысячи и десятки тысяч атомов. Это, по сути, уже не молекулы, а микрокристаллы, не имеющие постоянного числа атомов и движущиеся подобно броуновским частицам, коллектив которых ведёт себя как газ большой молекулярной массы. Размер таких кристаллов должен составлять порядка десяти поперечников атома гелия, т. е. — около 10 Å или 1 нм. Значит, гелий, всё же, переходит в твёрдое состояние (с чем и связан выход тепла), но ведёт себя при этом — как газ, поскольку тепловое движение и слабая связь инертных атомов гелия мешают нарастанию кристаллов и их агломерации. В итоге получается нечто среднее между газом и кристаллом — "газолёд", аэрозоль из кристаллов, снежная пыль, ледяной пар. По сути, это новое агрегатное состояние вещества. Вот в чём причина сходства свойств гелия и воды, содержащей микрокристаллы льда [120, 138]. Подобные же промежуточные состояния вещества, в форме жёстко связанных кристаллических комплексов, уже были рассмотрены для случая твёрдых тел и водорода (§ 4.15, § 4.16).
Кристаллы зарождаются уже в жидком гелии, причём их число и размеры нарастают с падением температуры. Именно с кристаллизацией связан размытый пик теплоёмкости гелия. Да и эксперименты показали, что в жидком гелии (как в воде) плавают кристаллики, насчитывающие сотни атомов, — "снежки" и "льдинки" [12, 138]. Как любые кристаллы, они нарастают вокруг ядер кристаллизации: ионов и электронов. Рост кристаллов в жидком гелии, как показал физик Аткинс, имеет чисто классические причины [12]. По мере укрупнения кристаллов расстояния между ними растут и, при определённой температуре (2,17 К), они оказываются столь велики, что жидкость переходит в газ (Рис. 184), причём, в силу плавности перехода, — не меняя плотности, словно в критической точке, где свойства жидкости и пара совпадают.
Рис. 184. В зависимости от давления и температуры микрокристаллы, вырастающие в жидком гелии, либо отдаляются, образуя "газовую" фазу, либо смерзаются в единую "снежную" массу гелия.
Но разве могли бы физики спутать газ и жидкость? В случае гелия это вполне возможно. Просто обычно газы не удаётся наблюдать в условиях, когда газ должен напоминать жидкость. Из-за низкой температуры его молекулы будут иметь ничтожную скорость, недостаточную даже для того, чтобы, преодолев силу тяжести, вылететь из сосуда. Такой газ уже не обладает основным свойством газов — заполнять весь предоставленный объём, а скапливается, подобно жидкости, на дне сосуда. В больших масштабах это происходит с земной атмосферой, которая не может покинуть Землю и разливается по ней воздушным океаном. Вот и газ He II возле абсолютного нуля выглядит как жидкость: его можно переливать из стакана в стакан, он течёт, словно жидкость, и, даже, обладает, за счёт заметного коэффициента преломления (плотность 146 кг/м 3), — призрачной, едва видимой и волнующейся "поверхностью раздела" (Рис. 185). Примерно так же, уже при комнатных температурах можно "переливать", словно жидкость, из стакана в стакан углекислый газ или зеленовато-жёлтый газ хлор, а также наблюдать, как от костра "фонтаном струй" взлетает разогретый воздух (имеющий чуть иной показатель преломления), или, — как стелится, течёт по земле туман, пар из охлаждённого воздуха.
Рис. 185. Газ из частиц гелия не способных покинуть сосуд.
В то же время, сам жидкий гелий He I сильно смахивает на газ. Он столь прозрачен и лёгок (плотность в десять раз меньше, чем у воды), что усомнишься, — не газ ли это? Как сказано в книге Карцева [61], такое сомнение охватило и Камерлинг-Оннеса, открывшего жидкий гелий: "…и вот уже сосуд наполнен чуть ли не до краёв кипящей жидкостью, настолько прозрачной, что увидеть её почти невозможно. Эта жидкость кажется невесомой, почти несуществующей. А может и нет её — жидкости…?". То же сомнение берёт и в отношении сверхтекучего гелия. Хотя внешне сверхтекучий гелий He II, как нечто среднее между газом и твёрдым телом (Рис. 181), и впрямь должен напоминать жидкость. Вот почему, наблюдая гелий возле абсолютного нуля, газ легко спутать с жидкостью, тем более если эту субстанцию нельзя "пощупать", изучить непосредственно.