Обычно атомы, ядра и элементарные частицы изображают шариками (что порой делалось для удобства и в данной книге), а, потому, мысль об их чёткой периодичной структуре, о кубической, пирамидальной форме частиц, с их рёбрами и гранями, кажется диковатой. Но, с другой стороны, атомы и частицы издавна называют элементарными кирпичиками, из которых построена материя. Так что же удивительного, если эти кирпичики имеют форму многогранников, как обычные строительные кирпичи, игрушечные кубики или детали конструктора? И что странного, если и сами эти кирпичи построены из ещё меньших кирпичиков, расположенных правильными, периодичными рядами? Не зря, Кеплер и Ломоносов, которые первыми научно обосновали атомарную и кристаллическую структуру вещества, считали атомы многогранниками, пирамидками [63]. А нынешние учёные, даже применив электронный микроскоп, ещё не получили чётких изображений атомов и лишь гадают об их форме.
Итак, классическая модель атома, мало того, что помогает наглядно и естественно объяснить механизм химической связи, но и позволяет установить глубокую аналогию химических и ядерных процессов, энергий и связей. Интересно, что эта геометро-механическая модель связи, впервые предложенная ещё Демокритом, возрождённая Ломоносовым, развитая Льюисом и Ленгмюром, но потом — надолго забытая, ныне вновь обрела признание, скажем в органической химии, в иммунологии, молекулярной генетике и в теории обонятельных рецепторов, где присоединение атомов и молекул часто происходит по принципу соответствия их геометрической формы, — по механизму ключ-замок. Не исключено, что такое представление о структуре материи, частицы которой связаны за счёт механического переплетения с образованием слоистых периодичных, шахматных структур (§ 3.12), формирующих затем объёмные тела и полые многогранники, отражены и в материальной культуре наших предков, для которых плетение, особенно венков и кос, имело глубокий символический смысл. Не случайно быт славян был основан на переплетении волокон льна, шерсти, волос, соломы, лыка, бересты, ивовых прутьев и даже брёвен, как видно на примере тканой одежды, лаптей, корзин, плетёных коробов, котомок, а также изб, теремов и других шедевров народного зодчества, возведённых без единого гвоздя. Если же наши предки-умельцы и применяли металл, то его они тоже переплетали наподобие волокон, когда соединяли вместе звенья цепей или кольца кольчуг (наиболее распространённых как раз на Руси), образующих такие же узоры, как цепочки и сетки связанных электронов и позитронов (Рис. 95, Рис. 102). Такой механизм формирования мира, путём плетения или связывания нитей материи и поля (истекающего из частиц, словно пряжа), отражён и в "Велесовой книге", составленной древнеславянскими учёными-волхвами. Аналогичные воззрения о том, что наш мир соткан из периодично расположенных зарядов противоположного знака, находим и в древнеиндийских "Станцах Дзиан": "И ткань эта есть Вселенная, сотканная из Двух Сущностей, воедино слитых".
§ 4.15 Вымерзание степеней свободы
Очевидно, теплота состоит во внутреннем движении материи… Внутреннее движение можно себе представить происходящим трояким образом: 1) неощутимые частицы непрерывно изменяют место, или 2) вращаются, оставаясь на месте, или, наконец, 3) непрерывно колеблются взад и вперёд… Первое мы назовём поступательным, второе вращательным, третье колебательным внутренним движением… При более быстром вращении частиц связанной материи должна увеличиваться теплота, а при более медленном — уменьшаться. Частицы горячих тел должны вращаться быстрее, более холодных — медленнее… Должна существовать наибольшая и последняя степень холода, которая должна состоять в полном прекращении вращательного движения частиц.
М.В. Ломоносов, "Размышления о причине теплоты и холода", 1750 г.
Ещё одним "подтверждением" квантовой теории в молекулярной физике считают явление вымерзания степеней свободы [19]. Известно, что двухатомная молекула, скажем, молекула водорода H 2, обладает пятью степенями свободы. Три из них связаны с поступательным движением молекул вдоль трёх осей, и две — с вращением вокруг двух осей (Рис. 172). На каждую степень свободы частицы приходится энергия kT/2, и двухатомная молекула обладает в среднем энергией 5 kT/2, где k —постоянная Больцмана, T— температура в кельвинах. Одноатомная же молекула наделена лишь энергией поступательного движения 3 kT/2. У двухатомных молекул реально есть ещё и энергия упругих колебаний атомов внутри молекулы. Поэтому, энергия реальных двухатомных молекул 7 kT/2.
Рис. 172. Энергии и степени свободы двухатомной молекулы (а) и атома в кристалле (б) связаны с поступательным движением, вращением и колебаниями.
В итоге, молярная теплоёмкость C(прирост внутренней энергии тела фиксированного объёма из N a=6·10 23молекул при нагреве на 1 ºС) для газа из реальных двухатомных молекул — 7 R/2; из жёстких двухатомных — 5 R/2; из одноатомных — 3 R/2 (здесь R=kN a— газовая постоянная). И, точно, при высоких температурах теплоёмкость водорода C=7 R/2, однако при охлаждении Cпадает до 5 R/2 (Рис. 173. а). А, с приближением к абсолютному нулю, Cстремится к 3 R/2, словно у молекул газа при охлаждении "вымерзают" (сковываются) степени свободы. Двухатомные молекулы сначала становятся жёсткими, а, при дальнейшем охлаждении, прекращают вращение, словно одноатомные.
Рис. 173. Изменение с температурой теплоёмкости а) двухатомного газа (водорода), б) твёрдого тела (медь).
Такое уменьшение теплоёмкости двухатомных газов, при понижении температуры, считалось противоречащим классической молекулярно-кинетической теории и нашло объяснение в квантовой теории, предложенной В. Нернстом, который и открыл феномен. Долгое время казалось, что классическая физика не совместима с этим феноменом. И, всё же, ему можно найти простое истолкование в традициях классики, стоит лишь принять модель атома Ритца. Тогда, при высоких температурах, атомы в полужёстких молекулах действительно колеблются, и C=7 R/2. При снижении температуры, энергии атомов уже не хватает для разрыва части связей и колебаний, — молекула становится "жёсткой". Например, атом водорода устроен таким образом, что в первом электронном слое (Рис. 104, Рис. 105), где всего два места, электрон занимает лишь одно (Рис. 170). Поэтому, электрон второго атома водорода попадает в вакантное место, образуя химическую связь. А пустующее место в слое второго атома — заполняется электроном первого. Так возникает молекула водорода H: H, где атомы H связаны ковалентной связью — из пары электронов, обозначенных по Ленгмюру точками (Рис. 174). При высоких температурах T, у большинства молекул водорода одна связь порвана, и молекула H ·H получается полужёсткой: её атомы могут вращаться, колебаться вокруг единственной точки связи, в виде электрона. При спаде температуры, энергии не хватает для разрыва связей, атомы полностью стыкуются, образуя двойную связь и жёсткую молекулу H: H, атомы которой уже не способны колебаться. Оттого и C=5 R/2 при такой не слишком высокой температуре.
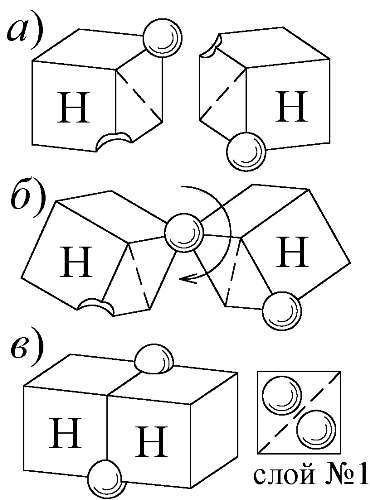
Рис. 174. При высоких T атомы водорода разделены (а). При снижении T один электрон обобщается, образуя полужёсткую молекулу H·H (б). При низких температурах в жёсткой молекуле H: H обобщены оба электрона (в).