В водороде одновременно присутствуют полужёсткие молекулы с одной связью H ·H и жёсткие, с атомами, скованными воедино двойной связью H: H. С понижением температуры, теплоёмкость плавно убывает от C=7 R/2 до C=5 R/2, поскольку плавно меняется соотношение числа молекул H ·H и H: H (Рис. 173. а). Как выяснили, охлаждение ведёт к снижению процента полужёстких молекул H ·H, отчего плавно спадает и теплоёмкость. В то же время, теоретически, газы из этих двух типов молекул можно разделить, ведь, за счёт разного строения, они должны различаться физико-химическими свойствами и спектрами (§ 3.4). И такое разделение водорода на два компонента с разными свойствами и спектрами, действительно, осуществлено в лабораториях [19, 134]. Из водорода удалось выделить два газа — ортоводород и параводород, обладающие разными свойствами и теплоёмкостями. Поскольку, при низких температурах водород почти полностью состоит из более устойчивого параводорода, то он, очевидно, образован частицами с парой связей H: H. Соответственно, ортоводород, возникающий при сильном нагреве, состоит из частиц H ·H, где одна из связей порвана.
Тот факт, что ортоводород можно преобразовать в параводород и — обратно, посредством химических методик (нагрев-охлаждение, катализаторы [134, с. 333]), доказывает, что различие меж ними вызвано не разной ориентацией спинов ядер, не ядерными свойствами [82], а — химическими, — разной структурой химических связей. Не случайно параводород H: H удаётся преобразовать в ортоводород H ·H, разорвав одну из связей, с помощью электрического разряда, применяемого обычно, как раз, — для ионизации молекул и разрыва в них атомных связей. Отметим, что в чистом состоянии параводород, а, тем более, ортоводород, получить сложно, а потому всегда имеют дело с их смесями, обогащёнными тем или другим компонентом. При этом, с течением времени, газ постепенно приходит в состояние с равновесной концентрацией орто- и параводорода [134]. И это — естественно, поскольку лишь при низких температурах атомы, пребывая в энергетически более выгодном состоянии, остаются прочно связаны в молекуле H: H. А, при высоких температурах, за счёт столкновений, связи постоянно то рвутся, то восстанавливаются: имеет место динамическое равновесие между молекулами орто- и параводорода, попеременно обращающихся друг в друга. Итак, при падении температуры именно рост концентрации параводорода H: H ( C=5 R/2), с параллельным падением процента ортоводорода H ·H ( C=7 R/2), ведёт к снижению теплоёмкости их смеси в водороде (Рис. 173. а).
С дальнейшим охлаждением вымерзает и вращательная степень свободы: двухатомные молекулы перестают вращаться, что тоже вполне объяснимо. Молекулы получают вращение от косых, боковых соударений, когда часть кинетической энергии в ходе удара переходит в энергию вращения. Но, с понижением температуры, молекулы всё чаще испытывают прямые, лобовые соударения, и уже не закручиваются. Ведь, при малой температуре частицы движутся медленно, отчего, в процессе сближения, электрические дипольные моменты молекул (созданные взаимной поляризацией) успевают сориентировать их перед ударом — вдоль линии сближения. Вдоль неё они и отскакивают, не получив вращения (Рис. 175). Именно так, двухатомный газ, при стремлении температуры к абсолютному нулю, и теряет вращательные степени свободы, ведя себя как одноатомный, — с теплоёмкостью C=3 R/2. При низких температурах имеет место классическое упорядочение, но, если у большинства газов упорядочиваются положения молекул от слияния их в кристаллы, то у водорода, остающегося газом вплоть до температуры в 14 K, упорядочивается само тепловое движение молекул.
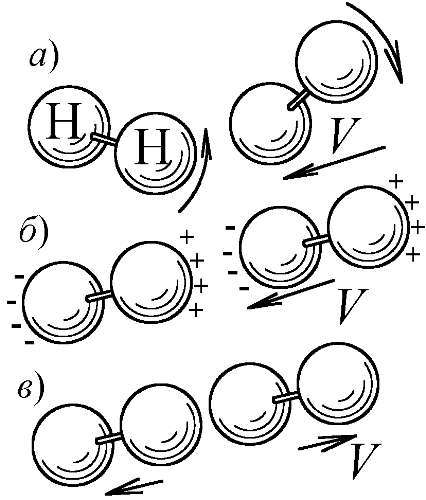
Рис. 175. Быстрое сближение молекул (а) ведёт к боковому удару и их закрутке, а при медленном они ориентируются (б) вдоль оси удара, не получив вращения (в).
Отсюда легко получить теоретические графики зависимости теплоёмкости газа от температуры, соответствующие экспериментальным данным (Рис. 173. а). Очевидно, что характерная температура, при которой идёт изменение теплоёмкости двухатомного газа — с 5 R/2 на 3 R/2, зависит от момента инерции молекулы. Чем массивней, инертней двухатомная молекула, тем медленней она поворачивается от дипольного электрического взаимодействия молекул. Поэтому, требуются меньшие скорости сближения и большее охлаждение для осуществления точной ориентации и прямого удара молекул, вместо косого. И, действительно, если у водорода снижение теплоёмкости становится заметно уже при 200 K, то у других газов, обладающих бóльшими молекулярными массами и моментами инерции, — при гораздо меньших температурах [19]. Также, температурный ход теплоёмкости различен для выделенных отдельно пара- и ортоводорода. Связано это, по-видимому, не только с разницей их молекул, но и с тем, что рост температуры ведёт к распаду молекул параводорода до ортоводорода. А дополнительная теплота (аналогичная теплоте плавления § 4.20), которую необходимо сообщать для нагрева параводороду, воспринимается как его увеличенная теплоёмкость C, превосходящая даже типичное для средних температур значение C=5 R/2 [19, с. 185]. Как видим, все квантовые эффекты имеют классическую молекулярно-кинетическую трактовку.
Интересно, что уже М.В. Ломоносов, построивший первый вариант молекулярно-кинетической теории теплоты, газов, жидкостей, растворов и твёрдых тел, чётко различал все три вида возможного теплового движения частиц тела. Огромную роль Ломоносов отводил именно вращательному движению молекул, которое замедляется с уменьшением температуры и сопровождается соответствующим уменьшением теплотворных свойств вещества. Таким образом, Ломоносов, даже без помощи математического аппарата, открыл, за век до Гельмгольца, Джоуля, Кельвина, Максвелла и других, — молекулярно-кинетическую теорию тепла и существование абсолютного нуля температуры ("последней степени холода, состоящей в полном прекращении движения частиц"). Кроме того, Ломоносов приблизился к пониманию роли вращательного движения частиц в образовании теплоёмкости тел, с его остановкой, при стремлении температуры к абсолютному нулю. Тем самым, Ломоносов проявил себя как стойкий сторонник атомизма Демокрита, в отличие о В. Нернста, который, открыв явление уменьшения теплоёмкости газа, при стремлении его температуры к абсолютному нулю, поспешил объяснять этот феномен с помощью гипотезы квантования вращательного движения молекул [156]. И это не удивительно, ведь Нернст, будучи учеником Оствальда, этого ярого сторонника энергетизма, воспринял его взгляды, близкие к кванторелятивистским (§ 5.14).
В действительности, как видим, явление не содержит ничего сверхъестественного и обретает наглядную классическую трактовку. Поэтому, обнаружив отклонения от классических законов, следует уточнять классическую модель, учтя неидеальность модели и приблизив её к реальности, а не отвергать сходу. Именно так Ван-дер-Ваальс, для объяснения отклонений от молекулярно-кинетической теории (МКТ), проявляющихся, опять же, и в изменении теплоёмкости, — предложил учесть в законе идеального газа конечный размер молекул и их взаимодействие, тем самым открыв точный закон [19, 45]. А физики нового поколения, такие как В. Нернст, наверняка предпочли бы отвергнуть классическую модель и вывести уравнение Ван-дер-Ваальса из квантовых законов. Итак, правильный путь развития физики пролегает через уточнение классических моделей и отход от идеализаций, работающих в узких рамках. Следуя путём Ван-дер-Ваальса, учтя взаимодействие атомов, их размеры, ограничивающие колебания, вращение, мы классически объяснили поведение теплоёмкости. Физики, начиная с А. Эйнштейна и В. Нернста, игнорировали рациональный путь Ван-дер-Ваальса и сгоряча (по недомыслию или по злому умыслу) отвергали классические модели, нагромождая квантовых.