«Молдова-фильм»
«Молдо'ва-фильм» , киностудия художественных и хроникально-документальных фильмов в Молдавской ССР. Находится в Кишиневе. Первоначально, с 1944, здесь работал корреспондентский пункт Центральной студии документальных фильмов, в 1947 он был передан в ведение Киевской студии кинохроники. В 1952 образована Кишиневская киностудия хроникально-документальных фильмов, с 1957 киностудия художественных и хроникально-документальных фильмов; с этого же года называется «М.-ф.». См. Молдавская ССР , раздел Кино.
Молдовеняска
Молдовеня'ска (буквально — молдавская), молдавский народный танец. Музыкальный размер 2 /4 со счётом на 2. Темп быстрый. В композиционной структуре преобладает форма рондо (запев — припев). Круг, которым обычно начинают М., образуется каждый раз с новой фигуры. М. распространена не только в художественной самодеятельности, но и на профессиональной балетной сцене. В Болгарии бытует вариант танца под названием «мулдуванска».
Лит.: Ткаченко Т., Народный танец, М., 1954.
Молдовская возвышенность
Молдо'вская возвы'шенность (Podişul Moldovei), возвышенность на В. Румынии, между рр. Прут и Сирет. Длина с С.-З. на Ю.-В. около 300 км, высота до 564 м (в пределах плато Бырлад). Сложена известняками, песчаниками и глинами неогена. Состоит из изолированных гряд холмов с плоскими междуречьями и крутыми склонами, глубоко расчленёнными оврагами и притоками рр. Прут, Сирет и Бырлад. Климат умеренно континентальный, осадков 600—700 мм в год на С. и 400—500 мм на Ю. Растительность преимущественно лесостепная. На междуречьях сохранились леса — буковые на С., дубовые с примесью граба на Ю. Значительная часть М. в. возделана (поля пшеницы и кукурузы, сады, виноградники).
Молдовяну
Молдовя'ну (Moldoveanu), горная вершина в Южных Карпатах, в массиве Фэгэраш, наиболее высокая точка Румынии (2543 м ). Сложена кристаллическими породами. На склонах — хвойные леса и высокогорные луга.
Молдотау
Молдота'у, горный хребет во Внутреннем Тянь-Шане, в Киргизской ССР, к Ю. от озера Сонкёль. Протягивается в целом с З. на В., между долинами рр. Кёкёмерен, Сонкёль и Нарын. Длина около 150 км. Высота до 4100 м. Сложен главным образом известняками. На нижних участках склонов — горные степи и луга, выше — участки еловых лесов, арчевники.
Молекула
Моле'кула (новолат. molecula, уменьшительное от лат. moles — масса), наименьшая частица вещества, обладающая его химическими свойствами. М. состоит из атомов, точнее — из атомных ядер, окружающих их внутренних электронов и внешних валентных электронов, образующих химические связи (см. Валентность ). Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул данного вещества не зависят от способа его получения. В случае одноатомных молекул (например, инертных газов) понятия М. и атома совпадают.
Впервые понятие о М. было введено в химии в связи с необходимостью отличать М. как наименьшее количество вещества, вступающее в химические реакции, от атома как наименьшего количества данного элемента, входящего в состав М. (Международный конгресс в Карлсруэ, 1860). Основные закономерности строения М. были установлены в результате исследования химических реакций, анализа и синтеза химических соединений, а также благодаря применению ряда физических методов.
Атомы объединяются в М. в большинстве случаев химическими связями. Как правило, такая связь создаётся одной, двумя или тремя парами электронов, которыми владеют сообща два атома. М. может содержать положительно и отрицательно заряженные атомы, т. е. ионы; в этом случае реализуются электростатические взаимодействия. Помимо указанных, в М. существуют и более слабые взаимодействия между атомами. Между валентно не связанными атомами действуют силы отталкивания.
Состав М. выражают формулами химическими . Эмпирическая формула (например, С2 Н6 О для этилового спирта) устанавливается на основании атомного соотношения содержащихся в веществе элементов, определяемого химическим анализом, и молекулярной массы .
Развитие учения о структуре молекул неразрывно связано с успехами прежде всего органической химии. Теория строения органических соединений, созданная в 60-х гг. 19 в. трудами А. М. Бутлерова , Ф. А. Кекуле , А. С. Купера и др., позволила представить строение молекул структурными формулами или формулами строения, выражающими последовательность валентных химических связей в М. При одной и той же эмпирической формуле могут существовать М. разного строения, обладающие различными свойствами (явление изомерии ). Таковы, например, этиловый спирт С5 Н5 ОН и диметиловый эфир (СН3 )2 О. Структурные формулы этих соединений разнятся:
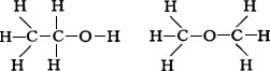
В некоторых случаях изомерные М. быстро превращаются одна в другую и между ними устанавливается динамическое равновесие (см. Таутомерия ). В дальнейшем Я. Х. Вант-Гофф и независимо французский химик А. Ж. Ле Бель пришли к пониманию пространственного расположения атомов в молекуле и к объяснению явления стереоизомерии. А. Вернер (1893) распространил общие идеи теории строения на неорганические комплексные соединения. К началу 20 в. химия располагала подробной теорией строения М., исходящей из изучения только их химических свойств. Замечательно, что прямые физические методы исследования, развитые позднее, в подавляющем большинстве случаев полностью подтвердили структурные формулы химии, установленные путём исследования макроскопических количеств вещества, а не отдельных М.
В физике понятие о М. оказалось необходимым для объяснения свойств газов, жидкостей и твёрдых тел. Прямое экспериментальное доказательство существования М. впервые было получено при изучении броуновского движения (французский физик Ж. Перрен, 1906).
В твёрдом теле М. могут сохранять или не сохранять свою индивидуальность. Так, большинство М. органических соединений образует молекулярные кристаллы , в узлах решёток которых находятся М., связанные одна с другой относительно слабыми силами межмолекулярного взаимодействия. Напротив, в ионных (например, в случае NaCI) и атомных (алмаз) кристаллах нет отдельных М. и весь кристалл подобен одной М. (см. Кристаллохимия ). Структура М. может изменяться при переходе от кристалла к газу. Так, N2 O5 в газе состоит из единых М., в кристалле — из ионов NO2+ и NO3- ; газообразный PCI5 — из М. с конфигурацией тригональной бипирамиды, твёрдый — из октаэдрического иона PCl6- и тетраэдрического иона PCl4+ .
Равновесные межъядерные расстояния r0 и энергии диссоциации D (при 25°С) некоторых двухатомных молекул
| Молекула | r0, Ǻ | D, кдж/моль (ккал/моль ) | Молекула | r , Ǻ | D,Кдж/моль (ккал/моль ) |
| H2 | 0,74 | 426,5 (104,18) | Br2 | 2,14 | 192,7 (46) |
| Li2 | 2,67 | 104,7 (25) | I2 | 2,67 | 147,1 (35,1) |
| N2 | 1,09 | 94,3 (22,5) | LiH | 1,59 | 243 (58) |
| O2 | 1,21 | 495,7 (118,3) | NaH | 1,89 | 196,9 (47) |
| F2 | 1,48 | 155 (37) | HhF | 0,92 | 565,6 (135) |
| Na2 | 3,08 | 78,5 (17,3) | HCl | 1,27 | 431,6 (103) |
| Cl2 | 1,99 | 242,6 (57,9) | HI | 1,60 | 264 (63) |