Следует напомнить, что частоты волн в спектре излучения атома водорода описываются формулой Ридберга:
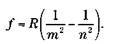
Сравнив эти выражения, мы увидим, что величины энергии Е(n) пропорциональны 1/n² . Именно в этом и заключалась гипотеза Бора, который использовал классические уравнения, чтобы определить искомый коэффициент пропорциональности. В современных учебниках приводится иная, однако эквивалентная, формулировка, в которой предполагается, что момент импульса электрона, находящегося на стационарной орбите, кратен постоянной Планка h. Бор смог выразить постоянную Ридберга через массу электрона, его электрический заряд и, естественно, постоянную Планка. Вычисленное значение совпадало с экспериментальным в пределах погрешности измерения. Таким образом, модель Бора, основанная на разумной, однако ничем не подтвержденной гипотезе, точно описывала результаты экспериментов и стала прекрасной отправной точкой в изучении структуры атомов. Целое число n, которое фигурирует в формуле Бора, называется главным квантовым числом.
Тонкая структура
В этот момент в дело вмешался Зоммерфельд, который в 1916 году, в разгар Первой мировой войны, рассмотрел возможность существования более общих квантовых условий, позволяющих описать атом водорода. Бор предположил, что электроны движутся по круговым орбитам, однако в общем случае орбиты электронов в планетарной модели имеют форму эллипсов. Окружность описывается одной величиной, радиусом, эллипс – двумя, а именно длиной большей и меньшей полуосей. Следовательно, предположил Зоммерфельд, чтобы описать состояние электрона, требовались два квантовых числа. В своих рассуждениях он использовал то же главное квантовое число, п из модели Бора, которое принимало значения 1, 2, 3, … Другое квантовое число, которое он обозначил через k, принимало значения от 1 до n. В современной нотации мы используем число I = k – 1, которое принимает значения от 0 до n – 1. Зоммерфельд обнаружил, что стационарные состояния, характеризующиеся одним и тем же значением n и разными значениями l, имеют одинаковую энергию как для круговой, так и для эллиптической орбиты. Такие состояния называются вырожденными для квантового числа l.
В дополнение к этому Зоммерфельд рассмотрел релятивистские эффекты. Если скорости элементов системы составляют значимую часть скорости света (1% уже является значимой частью), законы классической физики перестают действовать. Зоммерфельд не привел строгое решение релятивистской задачи, а ограничился тем, что нашел приближенное выражение для расчета энергии. Его результат был равен выражению, полученному Бором, с поправкой, зависевшей от чисел n и l. Иными словами, релятивистские эффекты нарушали вырожденное состояние. Поправка зависела от квадрата величины а = e²/(hc), которая, в свою очередь, зависит от величины заряда электрона e, скорости света c и редуцированной постоянной Планка h («аш со штрихом»), равной постоянной Планка h, разделенной на 2π. Величина поправки называется постоянной тонкой структуры и равна примерно 1/137036. Релятивистская поправка очень мала, поэтому ее можно наблюдать лишь при использовании более точных спектроскопических методов (отсюда и название «постоянная тонкой структуры»). Таким образом, обобщение Зоммерфельда, в котором вводилось второе квантовое число, позволяло объяснить еще не известные эффекты.
Физики начали понимать всю сложность спектров, однако им по-прежнему приходилось использовать ничем не обоснованные предпосылки. Ученые не понимали, почему электрон не испускал излучение, находясь на стационарной орбите, и ограничивались объяснением событий, происходивших во время перехода с одной орбиты на другую, – квантовых скачков. Без ответа оставалось множество вопросов, например: что происходило в атомах, имевших много электронов? Все электроны или их часть могли располагаться на одной круговой орбите, на концентрических орбитах или, возможно, их орбиты пересекались. Благодаря своей интуиции Бор смог получить первое представление о периодической системе элементов. Вся эта совокупность более или менее обоснованных предположений стала называться «старой квантовой теорией», в отличие от возникшей «новой». Упомянем еще несколько задач, рассмотренных в старой квантовой теории.
С появлением новых дифракционных решеток стало возможным измерять спектры со все большей точностью. Это можно сравнить с подбором очков: когда человек с плохим зрением идет к окулисту, то вначале видит лишь расплывчатые фигуры, а затем, примеряя линзы, постепенно начинает различать очертания букв. Аналогично, с ростом точности наблюдений атомные спектры демонстрировали все более сложную структуру. На рубеже 1920-х годов ученые смогли увидеть, что некоторые линии спектров атомов щелочных металлов, в частности натрия и калия, были двойными, а линии спектров щелочноземельных металлов, к примеру магния и кальция, – даже тройными. Испанский ученый Мигель Каталан, исследовав спектры магния и хрома, показал, что существуют кратные линии спектров, состоящие из четырех, шести и даже восьми линий. Кроме того, было известно, что в электростатическом или магнитном поле линии спектра также удваивались. Таким образом, в действительности модель Бора описывала атомный спектр водорода весьма приближенно. Однако это был первый важный шаг в правильном направлении.
Модели Бора, Зоммерфельда и тонкая структура
Представим некоторые формулы, описывающие атом водорода. Энергия стационарного состояния в модели Бора определяется выражением
где n – главное квантовое число, R – постоянная Ридберга. Бор получил выражение
где m – масса электрона, е – его электрический заряд, h – редуцированная постоянная Планка.
В расширенной модели Зоммерфельда использовалось второе квантовое число, которое мы обозначили буквой l, принимающее значения от 1 до n. С помощью релятивистских поправок Зоммерфельд определил, что энергия стационарного состояния определяется как
где α – постоянная тонкой структуры. Большее значение поправки, соответствующее квантовым числам n = 1 и l = 0, равняется 1 + α²/4 и равно 1,000013…, то есть примерно одной стотысячной.
Эффект Зеемана и модель каркаса атома
Спустя несколько недель после того, как Зоммерфельд допустил Гейзенберга на свои семинары, он предложил новому студенту задачу, которую не мог решить сам. В 1895 году голландский физик Питер Зееман (1865-1943) обнаружил, что в присутствии магнитного поля некоторые спектральные линии утраиваются. Появление дополнительных линий не зависело от анализируемого вещества и определялось магнитным полем. Этот эффект можно было объяснить с помощью законов классической физики, однако ученых интересовала его интерпретация в рамках обобщенной модели атома, предложенной Зоммерфельдом. Электрон, движущийся по замкнутой орбите, эквивалентен электрическому току в катушке, который, в свою очередь, порождает магнитное поле. Это магнитное поле взаимодействует с внешним магнитным полем, при этом энергия их взаимодействия зависит от угла между ними. Зоммерфельд предположил, что этот угол также описывается квантовыми законами и может принимать только дискретные значения, определяемые неким квантовым числом. Это число Зоммерфельд назвал магнитным числом и обозначил его буквой m. Таким образом, в магнитном поле энергия стационарного состояния зависела от трех квантовых чисел: n, l, m. Далее Зоммерфельд попытался рассчитать частоты перехода на основе разности энергий и сравнить их с наблюдаемыми линиями спектра.