Вернемся к атому гелия и уточним описанные выше обозначения. Волновая функция каждого электрона представляет собой произведение пространственной части, в которой для обозначения трех квантовых чисел используются буквы n и m, и спиновой части. Для обозначения пространственной части волновой функции используем греческую букву φ(фи) и будем записывать φn(1) и φm(2). В спиновой части два возможных состояния спина обычно обозначаются греческими буквами альфа и бета, поэтому будем записывать α(1) и β(2).
Волновая функция для двух электронов будет записываться так:
φm(1)φn(2)α(1)β(2) – φm(2)φn(1)α(2)β(1).
Это в самом деле антисимметричная комбинация: при смене индексов электронов мы получим тот же результат, но с противоположным знаком. Кроме того, если обозначения состояний равны, итоговый результат равен нулю. Таким образом, принцип Паули выполняется.
Данному принципу удовлетворяет и следующая линейная комбинация:
[φm(1)φn(2) + φm(2)φn(1)] • [α(1)β(2) – α(2)β(1)].
Это произведение симметричной комбинации пространственных частей и антисимметричной комбинации спиновых частей. Аналогично определяется следующая комбинация:
[φm(1)φn(2) – φm(2)φn(1)] • [α(1)β(2) + α(2)β(1)].
Она обладает обратными свойствами симметрии и определяется как произведение антисимметричной комбинации пространственных частей на симметричную комбинацию спиновых частей. Можно убедиться, что суммы этих двух новых линейных комбинаций за исключением общего множителя равны первой волновой функции, записанной нами для двух электронов. Однако новый способ записи содержит больше физической информации. Гейзенберг показал, что эти новые выражения описывают два разных множества состояний атома гелия, а именно линии спектра парагелия и ортогелия. В первом случае спиновая часть антисимметрична и соответствует синглетному состоянию – единственному состоянию общего спина. В примере с ортогелием спиновая часть симметрична, что соответствует триплетному состоянию, то есть трем возможным состояниям с одним и тем же значением общего спина. Следовательно, загадка двух видов гелия объясняется, если мы рассмотрим спин электрона: два вида гелия соответствуют двум возможным сочетаниям этих спинов.
Гейзенберг применил эти же идеи при изучении молекулы водорода, содержащей два протона и два электрона, и предсказал существование двух форм водорода, которые также назвал параводородом и ортоводородом. Они были открыты в 1929 году. Это два состояния молекулы с различным общим спином, которые сосуществуют при определенной температуре окружающей среды. Соотношение параводорода и ортоводорода равно 1:3. Как указано в заявлении Нобелевского комитета, Гейзенберг получил Нобелевскую премию по физике «за создание квантовой механики, применение которой привело, в частности, к открытию аллотропных форм водорода».
Квантовая неопределенность
В мае 1926 года Гейзенберг вернулся в Копенгаген – ему предстояло провести целый год в роли помощника Нильса Бора. К этому времени он уже достаточно хорошо говорил по-датски, чтобы преподавать. Бор был рад его возвращению и в письме к Резерфорду сообщал: «Приехал Гейзенберг, и все мы очень заняты обсуждением нового пути развития квантовой механики и перспектив, которые она открывает перед нами».
Как-то раз немецкий посол в Копенгагене пригласил Гейзенберга в свою резиденцию на музыкальный вечер – один из его сыновей, Карл Фридрих фон Вайцзеккер, интересовался физикой и захотел увидеть талантливого ученого. Гейзенберг постоянно общался с юными скаутами, поэтому легко завязал дружеские отношения с сыном посла, хотя тот был на 10 лет младше и учился в средней школе. Много лет спустя Вайцзеккер защитил докторскую диссертацию под руководством Гейзенберга и стал одним из его немногих близких друзей.
Бор пригласил Шрёдингера обсудить интерпретацию квантовой механики. Как вспоминал Гейзенберг, спор между учеными начался уже на вокзале Копенгагена и продолжался каждый день с утра до позднего вечера. Шрёдингер жил в доме Бора, и укрыться от дискуссий ему было некуда. И даже когда он, заболев, провел несколько дней в постели, Бор сидел у изголовья и продолжал спор. Позже Бор не раз вспоминал, как эта встреча повлияла на развитие его взглядов. После отъезда измученного Шрёдингера интерпретация квантовой механики стала главной темой бесед Бора и Гейзенберга на следующие несколько месяцев. Эти беседы были посвящены корпускулярно-волновому дуализму.
Вы уже знаете, что отправной точкой при создании матричной механики было представление об электроне как о частице, отправной точкой волновой механики – представление об электроне как о волне. Обе модели непротиворечивы и эквивалентны с математической точки зрения, однако это не помогало определить, что же такое электрон – частица или волна. Бор настаивал на том, что эти взаимоисключающие модели могут существовать одновременно, и считал, что они необходимы для полного описания физических явлений на атомном уровне. Продолжительные дискуссии совершенно вымотали и Бора, и Гейзенберга, и в конце февраля Бор отправился в отпуск в Норвегию. Вскоре после этого Гейзенберг открыл свои знаменитые неравенства.
В марте 1927 года ученый пишет в Копенгагене еще одну, крайне важную статью «О наглядном содержании квантовотеоретической кинематики и механики», где приводит соотношения, описывающие принцип неопределенности. Основная идея статьи приводилась в ее начале:
«Если мы хотим себе уяснить, что следует понимать под словом «положение объекта», например электрона (по отношению к заданной системе отсчета), необходимо указать определенные эксперименты, при помощи которых намереваются определить «положение электрона»; в противном случае это слово не имеет смысла».
Гейзенберг писал, что смысл физической теории заключен не в математических уравнениях, а в новых понятиях и их значении. До начала XX века основу физики составляла классическая механика Ньютона. В теории относительности были переопределены понятия пространства, времени и массы и продемонстрированы их ограничения при скоростях, сравнимых со скоростью света. Согласно Гейзенбергу, похожие изменения происходят и в том случае, если рассматривать объекты малой массы, которые перемещаются на очень малые расстояния, в частности электроны атомов.
Неопределенность и классические волны
На рисунке 1 показана волна, описываемая уравнением вида cos (2πk0(х–х0)), волновое число равно k0. Следовательно, ее неопределенность равна Δk = 0. Волна определена на всем пространстве, поэтому можно сказать, что она имеет бесконечную пространственную неопределенность Δх = oo.
На среднем рисунке изображена суперпозиция пяти волн, волновое число которых, k, очень близко к k0 . Эти волны изображены серым цветом, результирующая волна – черным. Из-за интерференции эта волна выглядит не так, как волна, изображенная вверху: в одних точках ее амплитуда увеличивается, в других – уменьшается. Рассмотрим суперпозицию бесконечного числа волн и присвоим каждой из них определенный вес, задаваемый гауссовой функцией
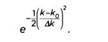
Иными словами, волновое число будет близко к k0 с отклонением Δk. График гауссовой функции представлен на рисунке 2. Функция принимает максимальное значение тогда, когда волновое число совпадает с центральным значением. Мы описали отклонение графика функции, когда она принимает значение е-1/2 , то есть примерно 0,61. На практике за пределами интервала, границы которого отстоят от центрального значения на три стандартных отклонения, значениями этой функции можно пренебречь. Результатом суперпозиции будет волна, подобная изображенной на рисунке 1, с волновым числом k0. Она будет описываться функцией