Размеры атомов и межэлектронные зазоры в слоях задают и межатомные расстояния в молекулах и кристаллах. Ближе атомы сойтись не могут. Однако, почему они не могут разойтись? Что удерживает атомы вместе в молекулах и кристаллах? Первое научное объяснение этому предложили те же Ленгмюр и Льюис, на основе разработанной ими кубической модели атома, по которой ядро атома послойно окружают электроны, занимающие устойчивые положения в вершинах кубов [19, 46]. Эта модель во многом соответствует бипирамидальной, поскольку бипирамида вписывается в куб (Рис. 170). Модель Ленгмюра без всяких оснований отвергли, приняв квантовую теорию химической связи с абстрактными электронными облаками, орбиталями и их перекрытием. Зато в классической модели всё выглядело предельно просто. Электроны послойно заполняли пространственные уровни, оболочки атомов — в форме куба. Если в атоме уровень был заполнен не до конца, его могли занять электроны других атомов, входящие в вакантное место, как ключ в замок. Это позволяло образовывать химические соединения — только определённым подходящим друг к другу по форме атомам и в строго заданном отношении. Например, атом кислорода имеет два свободных места на электронном уровне (Рис. 170). Поэтому, к нему могут пристыковаться два атома водорода, содержащие по одному электрону. Так образуется молекула воды (Рис. 171). Тогда угол между отрезками, соединяющими центры атомов, составит около 109° (угол меж диагоналями куба). Это соответствует реальному углу в 105–109°, измеренному у молекул воды в экспериментах [138].
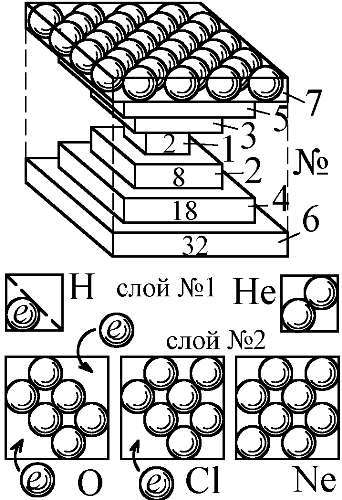
Рис. 170. Электронные слои атомов с вакансиями-петлями для образования химических связей или ионов O 2-, Cl -при захвате электронов e.
Всё это очень напоминает демокритову модель сцепления атомов по принципу "ключ-замок". Демокрит и Лукреций считали, что на атомах есть выпуклости и впадины, крючки и петли (см. эпиграф § 4.14). Когда выпуклость (крючок) одного атома попадает во впадину (петлю) другого, они соединяются, как детали игрушечного конструктора [105]. Выпуклости-крючки — это электроны одного атома, а вогнутости-петли, провалы, — не занятые электронами места в слое другого. Такую впадину будем в дальнейшем называть "вакансией", "пазом" или "гнездом", по аналогии с посадочным гнездом в конструкторе. Такой термин был предложен В. Мантуровым в его кристаллической модели ядра [79]. При этом, силы, удерживающие атомы вместе, имеют электрическую природу. Те же силы удерживают в слое электроны — это силы притяжения к электрон-позитронной решётке, аналогичные ядерным, только с иным масштабом (§ 3.12).
Рис. 171. Образование молекулы воды с углом между атомами водорода 109º.
Так получается предельно наглядная механическая картина связи атомов, сцепленных по принципу шипового соединения деревянных деталей мебели, где выпуклости, зубья, шипы одной доски попадают в пазы и прорези другой, входя с ними в зацепление. Эти периодичные ряды шипов, расположенных в шахматном порядке, вполне аналогичны электронной шахматной структуре атомов (Рис. 170). Только в атомах роль клея и сил трения, удерживающих шипы во впадинах, играют электромагнитные силы, удерживающие электроны в слое, в его не занятых участках. Кстати, именно по принципу "шип-впадина" устроен и широко применяемый в химии молекулярный конструктор из разноцветных шариков-атомов — с разным числом отверстий, в которых силами трения удерживаются связующие их прутики, изображающие электроны. Выходит, структурная химия отчасти вернулась к геометромеханической модели связи атомов (за счёт их форм, "шипов", "крючков" и "переплетений"), открытой ещё в античности, затем надолго забытой, но возрождённой Бойлем и Дальтоном [106]. Интересно, что ещё Демокрит и Лукреций, открывшие эту модель связи атомов, за счёт подобия их форм, предугадали, что связующим элементом (выпуклостями и крючками) должны быть те же мельчайшие частицы, что создают разряд молнии (электроны, см. § 4.17).
Так же легко модель объясняет существование отрицательных ионов. В боровской же модели атом не в силах связать избыточный электрон, а, тем более, — несколько. А, между тем, есть много отрицательных ионов, скажем Cl—, O2–. По Бору, нейтральный атом не удержал бы лишние электроны, зато, если учесть наличие в классической бипирамидальной модели вакансий в слое, то в них электрон-позитронная решётка вполне может связать и несколько лишних электронов. В атоме хлора всего одно свободное место (Рис. 170). Поэтому, атом захватывает один электрон и прочно его удерживает, образуя ион Cl—. В атоме кислорода слой имеет два незанятых места. Соответственно, по присоединении к ним электронов образуется ион O2–. Энергия связи электрона с атомом, в этом случае, называется "сродством к электрону". Она — того же порядка и той же природы, что энергия ионизации. Впрочем, если избыточных электронов чересчур много, отталкивание мешает их удержанию атомом.
Атому, в котором больше свободных мест, чем занятых, проще отдавать электроны. Таким образом, валентность атома, — его способность образовывать химическую связь, — определяется числом электронов, которые он может удержать или отдать. Причём, валентность определяется ещё и способом размещения электронов на уровне: электроны могут перемещаться внутри слоя, словно фишки в "пятнашках". Совершенно так же, как для нуклонов в ядре (§ 3.6), атом может образовывать несколько устойчивых конфигураций электронов, способных захватить или отдать больше или меньше электронов (как предположил ещё А. Майер § 3.1). Вот почему, одни и те же атомы могут проявлять разную валентность, образуя разное число связей. Эта первая и самая наглядная модель химической связи объясняет, как у атомов возникает данное число связей, почему энергия связи того же порядка, что и энергия ионизации (отрыва электрона). Квантовая же физика даёт невразумительные туманные объяснения, напоминающие мистические умствования Аристотеля, — вечного противника Демокрита [105]. Самое странное, что пошла эта квантовая теория химической связи из Гёттингена, словно по смерти Ритца власть там также перешла к его противникам, сторонникам неклассических взглядов: М. Борну, В. Гайтлеру, Ф. Лондону, В. Паули, В. Гейзенбергу [46]. Именно они развили абстрактную теорию связи бесструктурных атомов, посредством перекрытия туманных электронных орбиталей и квантового обменного взаимодействия, не имеющего отношения к обмену частицами, а связанному с перекрытием волновых функций электронов.
Рассмотренный выше классический механизм связи атомов работает не только в молекулах, но и в аморфных твёрдых телах, жидкостях, где связи носят беспорядочный характер, то возникая, то разрываясь, отчего атомы соединяются без всякой системы. Другое дело — кристаллы. В них связи упорядочены и порядок этот, возможно, задан во многом правильным строением атомов и электронных слоёв. Оттого и соединение атомов происходит в геометрически точном стиле. Аналогично, кирпичи, блоки, с их правильной формой, укладываются в зданиях и пирамидах правильным образом. Ещё лучше эти чёткие межатомные связи кристалла видны на примере паззла, квадратные детали которого, благодаря геометро-механическому зацеплению их выпуклостей и впадин, образуют целостную картину, напоминая кристаллическую решётку из атомов, образующих единое тело, кристалл. Уже давно открыто, что форма молекулярных кристаллов напрямую связана с формой молекул. Так же, и кубическая, октаэдрическая (бипирамидальная) форма алмазов, простых кристаллов, возможно, обусловлена такой же формой атомов. Квантовая теория химической связи не только неестественна, но и попросту не нужна, поскольку все особенности атомной связи (ионной, ковалентной и металлической) прекрасно объясняла созданная гораздо раньше классическая теория Томсона-Льюиса-Ленгмюра. Кванторелятивисты беззастенчиво присвоили себе успехи этой классической теории, забрав её терминологию, обозначения и принципы, лишь переиначив их на квантовый лад.