Б. к. в виде сложных эфиров и солей содержится в различных природных эфирных маслах, например гвоздичном. В медицине её применяют при кожных заболеваниях наружно как антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а натриевую соль Б. к. — как отхаркивающее средство. Кроме того, натриевую соль Б. к. используют при консервировании пищевых продуктов. Сложные эфиры Б. к. (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные Б. к., например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей.
Бензойная смола
Бензо'йная смола', росный ладан, быстро затвердевающая на воздухе смола, получаемая путём надрезов ствола и ветвей стираксового дерева (Styrax benzoin) семейства стираксовых , дикорастущего и разводимого в Юго-Восточной Азии и на островах Малайского архипелага. Имеет приятный запах благодаря присутствию в ней ванилина, коричной и (у некоторых сортов) бензойной кислот. Используется в парфюмерной промышленности.
Бензойный альдегид
Бензо'йный альдеги'д, бензальдегид, органическое соединение C6 H5 CHO; бесцветная маслянистая жидкость с запахом горького миндаля; tпл —26°С; tkип 179°С; в 100 г воды растворяется 0,3 г Б. а.; смешивается со спиртом, эфиром и др. органическими растворителями. Б. а. легко окисляется (даже на воздухе) до бензойной кислоты C6 H5 COOH, однако добавка 0,1% гидрохинона предотвращает (ингибирует) окисление. Б. а. присоединяет по СО-связи бисульфит натрия, синильную кислоту и др.; при кипячении Б. а. с раствором щёлочи образуются бензиловый спирт и бензойная кислота (см. Канниццаро реакция ); в присутствии CN-иона Б. а. вступает в бензоиновую конденсацию . При конденсации Б. а. с ацетальдегидом под действием щёлочи образуется коричный альдегид C6 H5 CH=CHCHO, с фенолами и ароматическими аминами — производные трифенилметана.
Б. а. в виде гликозида амигдалина, расщепляющегося водой на Б. а., глюкозу и синильную кислоту, содержится в косточках горького миндаля, абрикосов, персиков и др. Б. а. получают окислением толуола или гидролизом бензилиденхлорида C6 H5 CHCl2 ; большое значение имеет метод получения Б. а. из бензола и окиси углерода под действием хлористого алюминия. Б. а. применяют как душистое вещество, для синтеза коричного альдегида, бензоина, в производстве красителей трифенилметанового ряда и др.
Я. Ф. Комиссаров.
Бензол
Бензо'л, органическое соединение C6 H6 , простейший ароматический углеводород ; подвижная бесцветная летучая жидкость со своеобразным нерезким запахом; tnл 5,5°C; tkип 80,1°С; плотность 879,1 кг [м3 (0,8791 г/см3 ) при 20°С; n20D 1,5011. С воздухом в объёмной концентрации 1,5—8% Б. образует взрывоопасные смеси. Б. смешивается во всех соотношениях с эфиром, бензином и др. органическими растворителями; в 100 г Б. при 26°С растворяется 0,054 г воды; с водой образует азеотропную (постоянно кипящую) смесь (91,2% Б. по массе) с tkип 69,25°С.
Б. открыт М. Фарадеем . (1825), который выделил его из жидкого конденсата светильного газа; в чистом виде Б. получен в 1833 Э. Мичерлихом , сухой перегонкой кальциевой соли бензойной кислоты (отсюда название).
В 1865 Ф. А. Кекуле предложил для Б. формулу строения I, соответствующую циклогексатриену — замкнутую цепь из 6 атомов углерода с чередующимися простыми и двойными связями. Формулой Кекуле довольно широко пользуются, хотя накоплено много фактов, свидетельствующих о том, что Б. не обладает строением циклогексатриена. Так, давно установлено, что орто-дизамещённые Б. (например, 1,2 и 1,6) существуют лишь в одной форме, тогда как формула Кекуле допускает изомерию таких соединений (заместители у атомов углерода, связанных простой или двойной связью). В 1872 Кекуле дополнительно ввёл гипотезу о том, что связи в Б. постоянно и очень быстро перемещаются, осциллируют. Были предложены и др. формулы строения Б., однако они не получили признания.
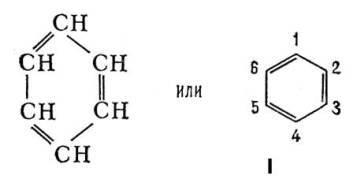
Химические свойства Б. формально в некоторой степени соответствуют формуле (1). Так, в определённых условиях к молекуле Б. присоединяются 3 молекулы хлора или 3 молекулы водорода; Б. образуется при конденсации 3 молекул ацетилена. Однако для Б. характерны в основном не реакции присоединения, типичные для ненасыщенных соединений, а реакции электрофильного замещения. Кроме того, бензольное ядро очень устойчиво к действию окислителей, например перманганата калия, что также противоречит наличию в Б. локализованных двойных связей. Особые, т. н. ароматические, свойства Б. объясняются тем, что все связи в его молекуле выравнены, т. е. расстояния между соседними атомами углерода одинаковы и равны 0,14 нм (1,40
), длина простой связи С—С 0,154
нм (1,54
) и двойной С = С 0,132
нм (1,32
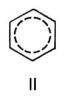
). Молекула Б. имеет ось симметрии шестого порядка; для Б. как ароматического соединения характерно наличие секстета p-электронов, образующих единую замкнутую устойчивую электронную систему. Однако до сих пор нет общепринятой формулы, отражающей его строение; часто используют формулу II.
Б. содержится в продуктах сухой перегонки каменного угля (коксовом газе) и небольшое количество — в коксовой смоле. Значительные количества Б. получают также каталитической циклизацией алифатических углеводородов нефти (см. Ароматизация нефтепродуктов ). Б. — важнейшее сырьё химической промышленности. При действии азотной кислоты на Б. образуется нитробензол С6 Н5 NО2 , который может быть восстановлен в анилин C6 H5 NH2 — исходный продукт в производстве многих красителей. При взаимодействии Б. с серной кислотой получается бензолсульфокислота C6 H5 SO2 OH, щелочное плавление солей которой — один из основных методов производства фенола . При алкилировании Б. этиленом в присутствии хлористого алюминия получается этилбензол, каталитическое дегидрирование которого представляет собой основной способ производства стирола C6 H5 CH=CH2 . Аналогично из Б. и пропилена образуется изопропилбензол C6 H5 CH (CH3 )2 — исходный продукт для получения фенола и ацетона в промышленном масштабе. Широко применяют и галогенопроизводные Б. Так, хлорбензол омыляется в фенол; из хлорбензола и магния Гриньяра реакцией получают фенилмагнийхлорид C6 H5 MgCI, при реакции которого с окисью этилена образуется b-фенилэтиловый спирт C6 H5 CH2 CH2 OH, используемый в парфюмерии как искусственное розовое масло. При каталитическом гидрировании Б. превращается в циклогексан — исходный продукт в одном из способов производства капролактама , полимеризацией которого получают синтетическое волокно «капрон». При облучении Б. присоединяет 3 моля хлора с образованием смеси стереоизомерных гексахлорциклогексанов, один из которых (гексахлоран) обладает сильными инсектицидными свойствами. Б. применяют в производстве взрывчатых веществ, а также как растворитель и экстрагирующее средство в производстве лаков, красок и др.