Кратко о жизни и деятельности Д. И. Менделеева. Он родился в Сибири (г. Тобольск), в семье директора гимназии. В 1855 г. окончил физико-математический факультет Главного педагогического института в Петербурге. Вел педагогическую работу (читал лекции по химии) в Петербургском университете, в 1856 г. защитил диссертацию и получил ученую степень магистра. В период 1859–1861 гг. находился в старейшем германском университете в г. Гейдельберге, работал в лаборатории, познакомился с находившимся там в это же время будущим известным ученым-химиком (и еще более известным в качестве выдающегося композитора) Александром Порфиръевичем Бородиным (1833–1887) и создавшим позднее русскую физиологическую школу Иваном Михайловичем Сеченовым (1829–1905), с которыми у Менделеева установились дружеские отношения. В 1861 г. Менделеев закончил работу над ставшим впоследствии широко известным учебником «Органическая химия». Возвратившись в Россию, Менделеев стал профессором Петербургского университета, а в 1865 г. защитил докторскую диссертацию.
В 1869–1871 гг. Менделеев написал капитальный двухтомный труд «Основы химии», вышедший только в нашей стране тринадцатью изданиями. В этом труде Менделеев изложил периодический закон элементов — свое наивысшее научное достижение.
Менделеев был не только известным ученым и педагогом, но и прогрессивным общественным деятелем. Он поддерживал борьбу студентов университета за предоставление университету большей самостоятельности и прав, за отмену полицейских функций инспекции университета.
Требования студентов не были удовлетворены, и Менделеев в знак протеста покинул университет. В 1876 г. Менделеев был избран членом-корреспондентом Петербургской Академии наук. Но в 1880 г., несмотря на большие к тому времени заслуги Менделеева перед наукой, он не был избран действительным членом академии, что вызвало возмущение общественности как в России, так и за рубежом, справедливо усмотревшей в этом отмщение за передовые взгляды Менделеева.
В 1893 г. Менделеев был назначен ученым хранителем Депо образцовых гирь и весов и работал там до конца жизни. Теперь эта организация называется Всесоюзный научно-исследовательский институт метрологии имени Д. И. Менделеева.
В жизни Менделеева всегда очень много значили эксперимент и тесная связь научных исследований с практикой, с производством. Так, например, в 1887 г., в возрасте 53 лет, Менделеев для наблюдения затмения Солнца поднимался один на воздушном шаре. Менделеев проявлял большой интерес к развитию нефтяной промышленности. Он часто посещал нефтяные промыслы в Баку, бывал в Донбассе, на Урале, на Кавказе. Большой интерес Менделеев проявлял к развитию сельского хозяйства, особенно к орошению земель на Нижней Волге, к внесению минеральных и органических удобрений.
Самым крупным научным достижением Менделеева было открытие периодического закона элементов и создание периодической системы (таблицы) элементов, носящей теперь его имя (с. 413).
Еще до открытия Менделеева были сделаны попытки классификации элементов. Так, в 1811 г. Берцелиус разделил все элементы на металлы и неметаллы (металлоиды). Металлы — элементы, которые в твердом и жидком состоянии непрозрачны, обладают особенным металлическим блеском, высокой тепло- и электропроводностью, соединяясь с кислородом образуют окислы, называемые основными, а соединяясь с водой — гидраты. Металлоиды — элементы, не обладающие названными свойствами металлов. Они легко соединяются с водородом, образуя прочные газообразные (как правило) соединения. Кроме Берцелиуса, классификацией элементов занимались немецкий химик Деберейнер, французский химик, один из основателей органической химии, Дюма[338] и некоторые другие ученые.
Однако только в 1869 г, Менделеевым был открыт периодический закон элементов, на основе которого была создана периодическая система элементов. В своей книге «Основы химии» Менделеев писал: «У элементов есть точное измеримое и никакому сомнению не подлежащее то свойство, которое выражается в их атомном весе. Величина его показывает относительную массу атома или, если избежать понятия об атоме, величина его показывает отношение между массами, составляющими химические самостоятельные индивидуумы или элементы. А по смыслу всех точных сведений об явлениях природы масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства, потому что все они определяются подобными же условиями или такими яке силами, какие действуют в весе тела; он же прямо пропорционален массе вещества. Поэтому блинке или естественнее всего искать зависимости между свойствами и сходством элементов, с одной стороны, и атомными их весами — с другой»[339].
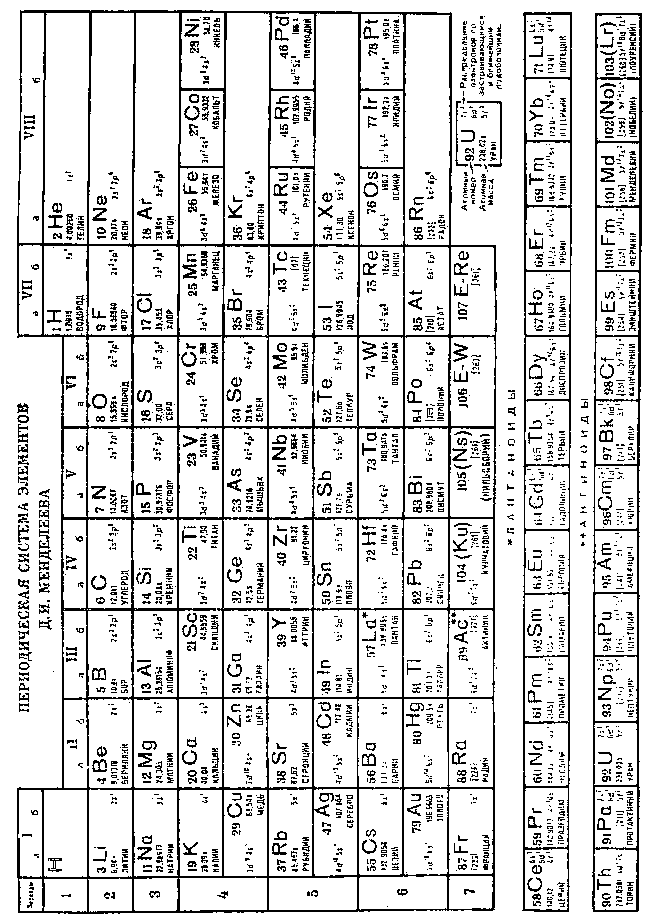
Оказалось, как установил Менделеев, химические свойства элементов изменяются не непрерывно с ростом атомного веса, а периодически. Другими словами, способность элементов к химическому взаимодействию, их валентность, не увеличивается плавно с ростом атомного веса, от каждого предыдущего элемента к последующему, а после некоторого увеличения снижается, потом снова растет и так далее. Менделеев в «Основах химии» написал об этом так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую функцию) от величины атомных весов элементов»[340].
Составляя периодическую систему элементов, Менделеев расположил их по горизонталям (периоды) в порядке увеличения атомного веса, причем так, чтобы элементы с близкими свойствами оказались в одном вертикальном столбце. Таким образом, горизонтальные строки — это периоды, а вертикальные столбцы — группы элементов, обладающих близкими свойствами. Получилось 8 групп и 12 периодов. Общее число открытых элементов составляло тогда (в 1871 г.) 63.
Мы не будем говорить здесь более подробно о таблице, составленной непосредственно Менделеевым. С тех пор прошло более 110 лет, число известных элементов возросло с 63 до 107; учение о строении атома, как известно читателю, продвинулось далеко вперед. Рассмотрим лучше несколько подробнее современную периодическую систему элементов Д. И. Менделеева.
Однако, прежде чем перейти к этому, рассмотрим еще один важный вопрос. Менделеев на основании периодической системы элементов высказал предположение о существовании некоторых, еще неизвестных тогда элементов — не все места в таблице Менделеева были заняты. Предвидение Менделеева оказалось правильным. В 1875 г. П. Лекеком де Буабодраном был открыт новый элемент — серебристый легкоплавкий металл, названный впоследствии галлием (Ga), существование и свойства которого были предсказаны Менделеевым под наименованием экаалюминия. В 1879 г. Л. Нильсон открыл новый элемент-металл скандий (Sc), на существование и свойства которого также ранее указывал Менделеев, именуя его экабором. В 1886 г. К. Винклер открыл новый элемент, используемый теперь в качестве полупроводника, — германий (Ge), названный так в честь родины Винклера; предвидя существование этого элемента, Менделеев именовал его экасилиций. Менделеев правильно предугадал существование впоследствии открытых еще семи новых элементов: технеция (Tc), рения (Re), полония (Ро), астата (At), франция (Fr), радия (Ra), протактиния (Pa).
Не правда ли, это напоминает предсказание Ньютоном (на основе проделанных им расчетов) новой планеты: Нептун, действительно открытой Галле в 1846 г.? В обоих случаях это существенно укрепило признание новых законов: закона всемирного тяготения Ньютона и периодического закона химических элементов Менделеева.
Периодическая система элементов Д. И. Менделеева разделена на группы и периоды элементов. Каждая группа разделяется на подгруппы: основную — а и побочную — b. Элементы одной и той же подгруппы имеют сходные химические свойства. Например, элементы подгруппы VIIa (галоиды) фтор (F), хлор (Сl), бром (Вr), йод (I) и астат (At) являются наиболее активными элементами среди металлоидов и поэтому очень редко встречаются в свободном состоянии. Все галоиды по отношению к водороду одновалентны и, соединяясь с ним, дают газообразные вещества типа PH. Что касается водорода (Н), то его место в периодической системе неоднозначно: он обладает свойствами, общими как с щелочными металлами (подгруппа Ia), так и с галоидами (подгруппа VIIa).