К концу этого процесса организм будет заполонен миллионами Т-клеток, несущих разные версии TCR. Они не реагируют сколь бы то ни было сильно на компоненты тела, но проявили очень слабую реакцию хотя бы на что-то. В организме Т-клетки часто контактируют со специфическим типом фагоцитов, которые демонстрируют им мелкие фрагменты того, что им удалось заглотить (в этом случае с помощью специальных белков, удерживающих эти фрагменты на поверхности клетки). Если фагоцит прибыл из очага инфекции, среди этих фрагментов будут кусочки микроорганизма. Большинство Т-клеток никак не реагируют на эти фрагменты, но иногда фагоциту может попасться Т-клетка, которая распознает его груз. Именно этого и ждет Т-клетка. Она полностью активируется, быстро делится, создавая целую армию дочерних клеток с таким же TCR, и выделяет сигнальные молекулы, которые привлекают другие Т-клетки в этот район. Некоторые из них распознают другие фрагменты микроба и тоже активируются. Часть Т-клеток отправится убивать клетки тканей, которые несут тот же фрагмент белка, ведь они, предположительно, заражены (рис. 79).
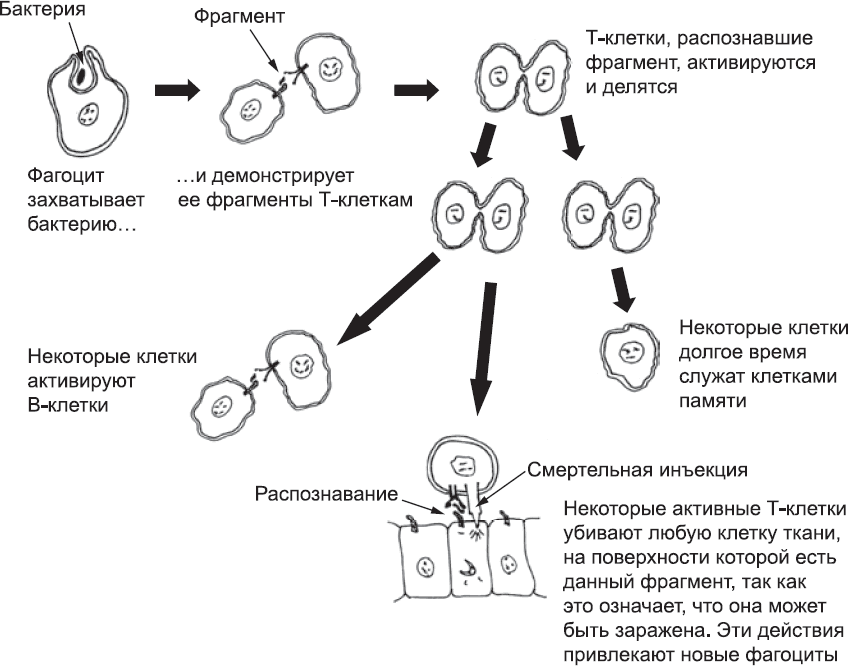
Рис. 79. Обобщенная схема некоторых способов, при помощи которых Т-клетки организуются и принимают участие в защитной реакции. Т-клетки имеют TCR, которые активируются, узнав показанный фагоцитом фрагмент бактерии. Разные события на этой схеме, например гибель клеток и использование системы комплемента, также могут привлекать фагоциты, вовлеченные во второй уровень иммунной реакции
Обучающий аспект этого процесса зависит как от деления вовлеченных в него клеток (что приводит к увеличению числа клеток с нужным типом TCR), так и от способности некоторых клеток оставаться в живых после гибели большинства других. Выжившие клетки становятся клетками памяти. Их присутствие означает, что, если тот же возбудитель болезни снова проникнет в организм, там будет гораздо больше клеток, способных распознавать его и запустить реакцию. Кроме того, клетки памяти более чувствительны к этому возбудителю, чем были любые клетки во время первого вторжения, и они меняют способы взаимодействия с остальной иммунной системой. В результате повторное вторжение того же патогена вызывает очень быструю и эффективную защитную реакцию. В таких условиях у вторгшихся микроорганизмов остается мало шансов на победу. Именно поэтому мы переносим большинство болезней только однажды, а затем у нас вырабатывается иммунитет и мы не заболеваем даже после непосредственного контакта с больным. Кажущиеся исключения, например простуда, на самом деле вызываются множеством различных микроорганизмов (в данном случае вирусов), так что всякий раз – это первый раз. Некоторые микроорганизмы, например возбудитель малярии, являются исключением, потому что в процессе эволюции у них появились механизмы обхода иммунной системы (это пример эволюционной «гонки вооружений», о которой я уже упоминал).
Т-клетки не единственные клетки тела, которые используют случайную перестановку нуклеотидов конкретных генов для производства огромного разнообразия рецепторов. Такой же прием используют В-клетки[325] при создании В-клеточных рецепторов (BCR). BCR очень похожи на TCR. Каждая В-клетка обладает только одним уникальным BCR. В-клетки патрулируют организм, и, если находят молекулу, которую могут распознать их BCR, они поглощают ее и «разрезают» с помощью ферментов. Затем они выставляют ее фрагменты на своей поверхности – на тот случай, если встретятся с Т-клетками, которые смогут их распознать. Если это произойдет, Т-клетка пошлет В-клетке сигнал, и та начнет делиться, образуя многочисленные В-клетки с тем же BCR. Некоторые дочерние В-клетки становятся клетками памяти, готовыми к предстоящим схваткам с тем же микроорганизмом, а другие начинают выделять свои BCR в окружающую жидкость (рис. 80). Секретированный BCR называется антителом. Он может быстро распространяться по тканям и связываться с распознаваемой молекулой, все еще плавающей в жидкости или уже находящейся на поверхности микроба или инфицированных клеток. Антитело задействует старейшую химическую защиту, а также фагоциты: таким образом оно выносит «смертный приговор» любой клетке, с которой связывается.
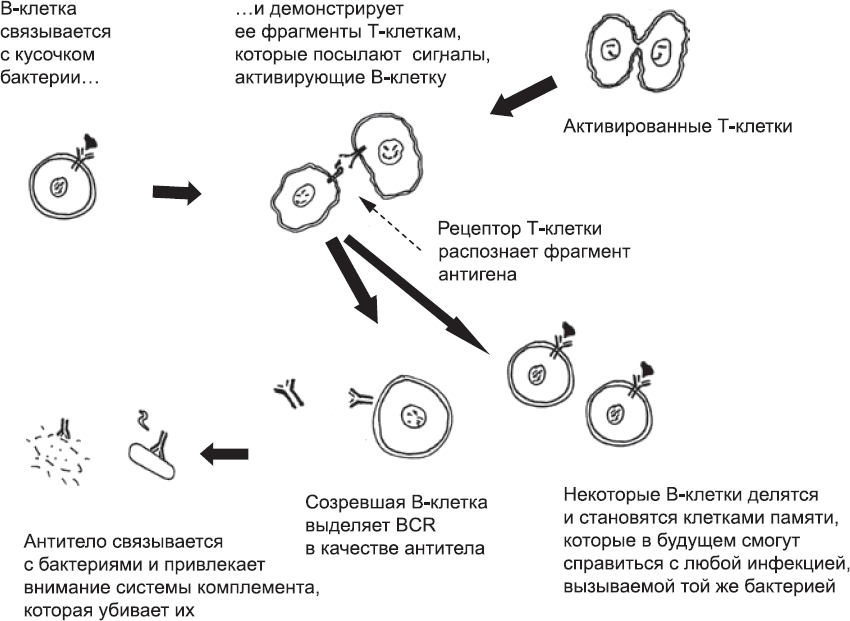
Рис. 80. Схема активации В-клеток. Если В-клетки связываются с участком бактерии, который распознал их BCR, то они демонстрируют его Т-клеткам. Если В-клетки находят Т-клетку, TCR которой распознает фрагмент, клетки обмениваются сигналами, и В-клетки активируются. Некоторые из них начинают делиться и становятся клетками памяти, которые смогут быстро активироваться при повторной инфекции. Остальные клетки созревают и производят антитела (свободные BCR). Антитело, сохранившее изначальную способность BCR связываться с этой конкретной бактерией, может задействовать систему комплемента и фагоциты и, следовательно, вызывать быструю смерть этих бактерий
Способность адаптивной иммунной системы к обучению лежит в основе вакцинации. В этом случае в организм вводят отдельные белки или безвредный или ослабленный штамм опасной бактерии или вируса, чтобы произошел первый «бой». Когда он закончится, у организма остаются клетки памяти T – и B-типа, которые смогут быстро и эффективно отреагировать, если когда-нибудь организм столкнется с настоящей болезнью. Для эффективной вакцинации, как правило, нужно, чтобы инъекция препарата вызывала достаточно сильное раздражение: она должна вызвать повреждение тканей, задействовать клетки и помочь молекуле-«мишени» продержаться достаточно долго, чтобы быть распознанной. Чистый белок в этом случае работает плохо. На этом примере хорошо видно, что начальная активация реакции адаптивной иммунной системы основана в конечном счете на древнем механизме производства сигналов тревоги от ткани в состоянии стресса или умирающей ткани, а также от бактериальных продуктов.
Адаптивная иммунная система не нуждается в априорном, генетически обусловленном знании химического строения противников, с которыми она столкнется. Как и мозг, она изменяется в зависимости от опыта, а Т – и В-клетки, которые активировали свои рецепторы в первой битве, становятся «отрядом быстрого реагирования», готовым снова нанести удар по знакомому врагу, не дожидаясь значительного повреждения тканей. Так что в данном случае выражение «все, что не убивает нас, делает нас сильнее» вполне справедливо.
Это краткое объяснение принципов работы адаптивной иммунной системы возвращает нас к вопросу о том, как же мы все-таки уживаемся с симбиотическими бактериями. Совсем недавно было обнаружено,[326],[327] что клетки человеческого кишечника, распознающие сигналы от симбиотических бактерий, посылают защитным системам сигналы, означающие: «ничего страшного здесь не происходит». Сигналы действуют на фагоциты, которые специализируются на демонстрации связанных с поверхностью фрагментов бактерий Т-клеткам. Эти фагоциты[328] могут быть в двух состояниях: в одном они демонстрируют фрагменты, сопровождая демонстрацию сигналами, которые побуждают Т-клетки начать агрессивную атаку, а в другом состоянии – сигналами, которые убеждают Т-клетки успокоиться и проявить терпимость. В норме клетки кишечника, которые контактируют только с симбиотическими бактериями, выделяют два белка, которые переводят фагоциты в зоне досягаемости в «спокойное» состояние. Фагоциты будут по-прежнему демонстрировать молекулы бактерий, частично переваренной пищи и т. д., но при этом будут способствовать толерантности, а не агрессии. Если же клетки стенки кишечника находятся в контакте с вредоносными бактериями, они посылают не успокаивающие сигналы, а сигналы тревоги. Тогда фагоциты демонстрируют Т-клеткам фрагменты бактерий вместе с сильными активирующими сигналами, и организм быстро мобилизует защиту. И в этом случае главным контролирующим элементом защитной реакции является то, испытывает ли ткань (в том числе ее иммунные клетки) стресс. А «диалог» между бактериями и стенкой кишечника добавляет к этому позитивный сигнал – ничего плохого не происходит.