В процессе эмбрионального развития сегментация человеческого тела начинается в мезодерме, лежащей слева и справа от нервной трубки. Клетки этой ткани, образовавшейся в процессе гаструляции (глава 4), вначале не очень прочно связаны между собой и не организованы каким-либо особым образом. В процессе сегментации, однако, эта ткань будет поделена на блоки, называемые сомитами, или первичными сегментами. Сомиты – предшественники позвонков, мышц и некоторых других структур тела. Они формируются не сразу, а последовательно, от шеи эмбриона к хвосту, и попарно (одновременно образуются два сомита – слева и справа от нервной трубки). У человеческого эмбриона каждая новая пара сомитов образуется примерно через шесть часов после предыдущей (рис. 22).
Задача превращения участка несегментированной ткани в сомит решается с помощью изменения адгезионных свойств клеток. Клетки, обладавшие высокими адгезионными свойствами в эктодерме до гаструляции, а затем превратившиеся в неплотную мезодерму, теперь повторно активируют свои адгезионные системы.[86] После этого они отделяются от своих бывших соседей по мезодерме и организуются в закрытые сферические структуры, похожие на цисты, – новые сомиты.
Рис. 22. Образование сомитов у человеческого эмбриона в возрасте примерно пяти недель. Уже сформированы шесть сегментов, которые дадут начало черепу и первым шейным позвонкам. Изображенный на рисунке зародыш по мере развития будет удлиняться в направлении низа страницы
Ясно, что все клетки несегментированной мезодермы не могут «включить» адгезию одновременно. Если бы это произошло, образовался бы один большой «мегасегмент» вместо необходимой серии небольших отдельных сомитов. Вместо этого эмбрион должен использовать какой-то особый механизм, чтобы сообщать коротким блокам клеток, что настал момент для изменения адгезионных свойств. При этом каждый сомит должен закончить формироваться еще до начала формирования следующего. Для выполнения этих условий клетки должны очень точно определять свое положение: находятся ли они именно в том ли месте, где должен образоваться сомит.
Уже на ранних этапах развития, когда эмбрион был еще очень мал, клетки по-разному реагировали на сигналы в зависимости от места и времени, например при создании первичной полоски. Например, во время гаструляции эмбрион был достаточно мал, чтобы градиент концентрации сигналов от ПВЭ определял примерную ориентацию оси «голова – хвост». Однако по мере роста эмбриона простой механизм градиентов концентрации стал все меньше подходить для разметки сложных структур организма. Чем длиннее ткань, которая должна быть размечена с помощью одного концентрационного градиента, тем более пологим будет градиент относительно размера любой клетки (рис. 23). Чем градиент более пологий, тем меньше разница концентраций для соседних клеток. Соответственно, клетке труднее «принимать решения», связанные с ее точным местоположением в эмбрионе. Системы концентрационных градиентов было вполне достаточно, чтобы наметить «черновые» различия поведения клеток раннего эмбриона, однако она просто не справится с задачей нанесения точной детальной разметки на тело, имеющее гораздо большую площадь.
Эмбрион решает эту проблему, не отбрасывая идею градиентов окончательно: он использует короткий градиент, чтобы определить границы одного сомита. Затем этот градиент, по длине равный длине сомита, передвигается вдоль эмбриона и используется снова и снова. Механизм, с помощью которого это достигается, кажется фантастическим по своей сложности, но его существование было подтверждено многочисленными кропотливыми экспериментами над эмбрионами различных видов животных. Несмотря на то что нам еще многое предстоит узнать об этом механизме, на данный момент мы знаем достаточно, чтобы сказать, что он вполне реален.
В течение всего этого процесса клетки мезодермы, еще не сегментированной и, следовательно, находящейся позади уже сформированных сомитов, синтезируют сигнальный белок под названием FGF.[87] Они делают это по умолчанию, и каждая из клеток будет продолжать синтезировать FGF, пока что-то ее не остановит. Клетки могут обнаружить секретированный ими же FGF, и это предотвращает такие изменения их адгезионных систем, которые необходимы для формирования сомита. Другими словами, еще не сегментированная мезодерма продолжает говорить себе «еще не пора» на языке FGF.[88]
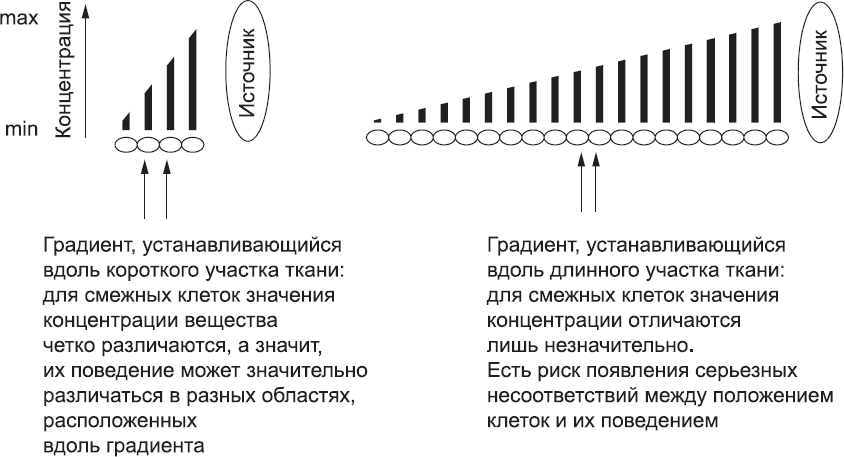
Рис. 23. Градиенты концентрации вещества, распространяющегося от источника, хорошо определяют положение клеток на небольших расстояниях, но с увеличением расстояния различия концентрации этого вещества для соседних клеток становятся незначительными. Учитывая «шум», свойственный биологическим системам, клеткам становится все труднее определить, находятся ли они внутри или же снаружи той концентрационной области, в которой их поведение должно измениться определенным образом. Фиксированные градиенты, следовательно, не подходят для разметки больших и сложных структур, формирование которых требует использования многих вариантов клеточного поведения, и не могут быть использованы для того, чтобы наметить границы между будущими сомитами эмбриона
Клетки, которые уже находятся в процессе создания сомитов, не выделяют FGF. Вместо этого они синтезируют еще одну сигнальную молекулу, ретиноевую кислоту, которая также образуется клетками в голове эмбриона. Ретиноевая кислота распространяется от последнего сомита к еще не сегментированной мезодерме. Она не может распространяться очень далеко, потому что мезодермой синтезируется молекула, которая разрушает ее. Тем не менее она может проникать в мезодерму в значительной концентрации на десятую долю миллиметра.[89] Ретиноевая кислота останавливает синтез FGF в мезодерме. Таким образом, образуется узкое «окно», или «разрешающая зона», в еще не сегментированной мезодерме, в котором не хватает FGF, чтобы предотвратить образование сомита (рис. 24).
Рис. 24. Противоположно направленные градиенты ретиноевой кислоты (РК) и FGF. Градиент РК имеет максимум на головном конце тела, а FGF – на хвостовом конце. Эти градиенты задают узкую «разрешающую зону», в которой клетки могут создавать новый сомит
Определение границ этого окна в пространстве является очень важной частью механизма, в ходе которого новые сомиты образуются один за другим, но этого пока недостаточно, чтобы решить проблему. В конце концов, если клетки смогут превратиться в сомиты, как только разрешающая зона перемещается достаточно далеко к хвосту, они будут делать это одна за другой. Никогда у каждого из сомитов не будет четкой задней части, потому что всегда другие клетки, избавившись от влияния ингибиторов, попытаются сказать «и я тоже!». Такая система не сможет разделить ткани на блоки, и все, что получится, это очень длинный, бесформенный «мегасомит». Однако эту проблему можно решить, если клетки не будут формировать сомит, пока разрешающая зона не переместится на расстояние, равное длине сомита, к хвосту.[90] Тогда все клетки в этой зоне будут иметь возможность участвовать в процессе. Но это возможно только тогда, когда разрешающая зона переходит на расстояние, равное длине следующего сомита, и так далее. Кажется, именно так устроена эта система в действительности: переключение между клетками в разрешающей зоне регулируется «тиканьем» молекулярных часов.