Что же представляет собой эта смесь?
Глазами физика и химика
Газообразный криптон в 2,87 раза тяжелее воздуха, а жидкий — в 2,14 раза тяжелее воды. Криптон превращается в жидкость при — 153,9°С, а уже при — 156,6°С он отвердевает. Заметим попутно, что малые температурные интервалы между жидким и твердым состояниями характерны для всех благородных газов. Это свидетельствует о слабости сил межмолекулярного взаимодействия, что вполне естественно: у этих атомов «замкнутые», целиком заполненные электронные оболочки. Молекула криптона одноатомна.
Криптон — первый из тяжелых благородных газов. Такое деление не искусственно. Обратите внимание на большой разрыв между значениями критических величин легких и тяжелых благородных газов. У первых они крайне низки, у вторых значительно выше. Так, точки кипения криптона и гелия разнятся, на 116,1°С. Сильно разнятся и другие важнейшие характеристики. Объяснить это логичнее всего характером сил межмолекулярного взаимодействия: с увеличением молекулярного веса благородного газа резко вырастает сила взаимопритяжения молекул.
Криптон — достаточно редкий и рассеянный газ. На Земле его больше всего в атмосфере — 3∙10-4% (по весу). Содержание криптона в атмосфере очень медленно (даже в масштабах геологических эпох) нарастает: криптон «выдыхают» некоторые минералы.
Природный криптон состоит из шести стабильных изотопов: 78Kr, 80Kr, 82Kr, 83ICr, 84Kr и 86Kr. И все они есть в горных породах, природных водах и атмосфере. Обильнее прочих представлен 84Kr, на его долю приходится 56,9% атмосферного криптона.
В ядерных реакциях искусственно получены 18 радиоактивных изотопов криптона с массовыми числами от 72 до 95. Некоторые из этих изотопов нашли применение как радиоактивные индикаторы и генераторы излучения.
Особо важным оказался криптон-85 — почти чистый бета-излучатель с периодом полураспада 10,3 года.
Спектр криптона изобилует линиями во всем видимом диапазоне, особенно в коротковолновой области. Самые яркие линии расположены между 4807 и 5870 Аº, оттого в обычных условиях криптон дает зеленовато-голубое свечение.
Благодаря хорошей растворимости в жидкостях организма криптон при парциальном давлении 3,5 атм уже оказывает наркотическое действие на человека.
А теперь о химии криптона.
В атоме криптона 36 электронов, распределенных на четырех энергетических уровнях (оболочках). Это обстоятельство в физическом и отчасти химическом смысле приближает криптон к обычным, «нормальным» газам. Почему?
В атомах тяжелых благородных газов внешние электронные оболочки замкнутые. Но будучи сравнительно отдаленными от ядра, оболочки получают некоторую автономность. Чем тяжелее атомы инертного газа, тем больше их способность объединяться с некоторыми другими атомами.
Химия «инертных» газов (теперь без кавычек не обойтись) — новая область науки. Но возникла она не на голом месте. Еще в первой четверти XX в. ученые наблюдали образование в электрическом разряде ионизированных молекул инертных газов и как будто бы соединений этих газов с другими элементами. Вне разряда эти образования быстро распадались, и первые сообщения о соединениях инертных газов казались малообоснованными.
Позже стали известны кристаллические клатратные[18] соединения криптона с H2O, H2S, SO2, галогеноводородами, фенолами, толуолом и другими органическими веществами. Они устойчивы даже при комнатной температуре под давлением 2–4 атм. Но еще в 40-х годах советский ученый Б. А. Никитин показал, что в клатратных соединениях связь молекулярная, в них валентные электроны не взаимодействуют.
В 1933 г. Лайнус Полинг, позже дважды лауреат Нобелевской премии, развивая представление о валентных связях, предсказал возможность существования фторидов криптона и ксенона. Но лишь в 1962 г. было получено первое такое соединение — гексафтороплатинат ксенона. Вслед за тем были синтезированы фториды криптона, ксенона, радона и многочисленные их производные.
Разумеется, соединения криптона и других благородных газов получить не легко. Так, кристаллический KrF2 был получен в результате воздействия тихого электрического разряда на смесь из фтора, криптона и аргона в молярном отношении 1 : 70 : 200. Условия реакции: давление — 20 мм ртутного столба, температура — минус 183°С.
Свойства дифторида криптона достаточно обычны: при комнатной температуре он неустойчив, но при температуре сухого льда (— 78°С) его можно хранить очень долго. И не только хранить, а и исследовать взаимодействие этих бесцветных кристаллов с другими веществами. Дифторид криптона — весьма активный окислитель. Он вытесняет хлор из соляной кислоты и кислород из воды. Реагируя с органическими соединениями, он не только окисляет их — иногда при этом происходит замена хлора на фтор в органической молекуле. Впрочем, многие органические вещества, например этиловый спирт, от соприкосновения с дифторидом криптона воспламеняются. Через фторид криптона получены соединения этого элемента с переходными металлами; во всех этих соединениях есть и фтор. Общая формула таких соединений KrF+MeF6-. Исключения составляют соединения мышьяка и сурьмы: Kr2F3+AsF6-, Kr2F3+SbF6- и KrF+Sb2F6-. В реакциях с дифторидом криптона как очень сильным окислителем были получены некоторые уникальные неорганические соединения — пентафторид золота AuF5, гептафторид брома BrF7, перброматы.
Извлечение из воздуха
Криптон получают из воздуха. Но чтобы получить литр элемента № 36, приходится переработать более миллиона литров воздуха. Тем не менее современные масштабы производства кислорода позволяют попутно извлекать довольно значительное и с каждым годом возрастающие количества криптона.
Как наименее летучие компоненты воздуха, криптон и ксенон скапливаются в самой «теплой» части воздухоразделительного аппарата вместе с жидким кислородом. Из него-то и выделяют элемент № 36.
Ожиженную кислородную фракцию направляют в ректификационную колонну, нижняя часть, или «пристройка», которой (конденсатор) охлаждается жидким азотом. Здесь получается «бедный» криптоновый концентрат, содержащий 0,1–0,2% Kr; этот «бедняк» в 400 раз богаче криптоном, чем исходный кислород.
Прежде чем продолжить ректификацию, «бедный» концентрат очищают от метана, ацетилена и прочих углеводородов. Такая операция необходима, чтобы исключить опасность взрыва на последующих стадиях отделения криптона. Микропримеси углеводородов в воздухе есть всегда. Причины их появления: испарение нефтепродуктов, утечка природного газа, бактериальный распад органических остатков и, наконец, промышленные выбросы.
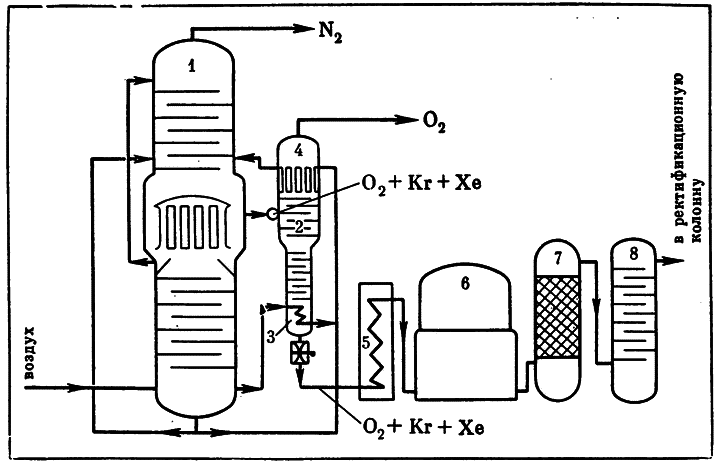
Схема извлечения криптона и ксенона из воздуха. Эти газы получают как ценные побочные продукты при разделении воздуха. Цифрами обозначены: 1 — основной аппарат для разделения воздуха на кислород и азот (он состоит из сочлененных ректификационных колонн: конденсатор нижней колонны служит испарителем верхней); 2 — дополнительная колонна для отделения криптона и ксенона; 3 — испаритель дополнительной колонны 4 — дефлегматор (конденсатор) дополнительной колонны; 5 — испаритель, в который из колонны — поступает кубовая жидкость, обогащенная Kr и Xe; 6 — газгольдер; 7 — контактный аппарат, в котором выжигают углеводороды; 8 — абсорбер для поглощения CO2. Из последней ректификационной колонны выходит газовая смесь, в которой 50–75% криптона и ксенона