Прежде всего оно позволяет определить максимальный кпд тепловой машины. Если машина работает на основе Карно цикла , то на протяжении изотермического контакта с нагревателем (Т = T1 ) рабочее тело получает количество теплоты D Q1 , а на другом изотермическом участке цикла, находясь в контакте с холодильником (Т = Т2 ), отдаёт ему количество теплоты D Q2 . Отношение DQ2/ DQ1 должно быть одним и тем же у всех машин с обратимым циклом Карно, у которых одинаковы соответственно температуры нагревателей и холодильников, и не может зависеть от природы рабочего тела. Если бы это было не так, то машину с большей величиной указанного отношения можно было бы заставить работать в обратном направлении (поскольку циклы обратимы), приводя её в действие с помощью машины с меньшей величиной отношения. Эта комбинированная машина обладала бы тем свойством, что в ней теплота от холодильника передавалась бы нагревателю без совершения работы. Согласно 2-му началу Т. это невозможно, и поэтому отношение DQ2 / DQ1 у обеих машин должно быть одинаковым. В частности, оно должно быть тем же, что и в случае, когда рабочим телом является идеальный газ. Здесь это отношение легко может быть найдено, и, таким образом, оказывается, что для всех обратимых циклов Карно
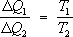
. (3)
Это выражение называется пропорцией Карно. В результате для всех машин с обратимым циклом Карно кпд максимален и равен h= (T1 — T2 )/T1 . В случае, если цикл необратим, то кпд оказывается меньше этой величины. Необходимо подчеркнуть, что пропорция Карно и кпд цикла Карно имеют указанный вид только в том случае, если температура измерена в абсолютной температурной шкале. Пропорция Карно положена в основу определения абсолютной температурной шкалы (см. Температурные шкалы ). Следствием 2-го начала Т. (пропорции Карно) является существование энтропии как функции состояний. Если ввести величину S, изменение которой при изотермическом обратимом сообщении системе количества теплоты DQ есть DS = DQ/T , то полное приращение S в цикле Карно будет равно нулю; на адиабатических участках цикла DS = 0 (так как DQ = 0), а изменения на изотермических участках компенсируют друг друга. Полное приращение S оказывается равным нулю и при осуществлении произвольного обратимого цикла, что доказывается разбиением цикла на последовательность бесконечно тонких циклов Карно (с малыми изотермическими участками). Отсюда следует (как и в случае внутренней энергии), что энтропия S является функцией состояния системы, то есть изменение энтропии не зависит от пути перехода. Используя понятие энтропии, Клаузиус (1876) показал, что исходная формулировка 2-го начала Т. полностью эквивалентна следующей: существует функция состояния системы, её энтропия S , приращение которой при обратимом сообщении системе теплоты равно
dS = dQ/T; (4)
при реальных (необратимых) адиабатических процессах энтропия возрастает, достигая максимальное значения в состоянии равновесия.
Термодинамические потенциалы. Определение энтропии позволяет написать следующие выражения для дифференциалов внутренней энергии и энтальпии:
dU = TdS – pdV, dH = TdS + Vdp. (5)
Отсюда видно, что естественными независимыми параметрами состояния для функций U и Н являются соответственно пары S, V и S, р. Если же вместо энтропии в качестве независимого параметра используется температура, то для описания системы более удобны свободная энергия (Гельмгольцева энергия , или изохорно-изотермический потенциал) F = U — TS (для переменных Т и V ) и термодинамический потенциал G = Н — TS для переменных Т и р (Гиббсова энергия , или изобарно-изотермический потенциал), дифференциалы которых равны
dF = – SdT – pdV, dG = –SdT + Vdp. (6)
Функции состояний U, Н, F и G называются потенциалами термодинамическими системы для соответствующих пар независимых переменных. Метод термодинамических потенциалов (Дж. Гиббс, 1874—1878), основанный на совместном применении 1-го и 2-го начал Т., позволяет получить ряд важных термодинамических соотношений между различными физическими свойствами системы. Так, использование независимости вторых смешанных производных от порядка дифференцирования приводит к связи между теплоёмкостями ср и cv , коэффициентом теплового расширения
и изотермическим коэффициентом сжатия
к соотношению между изотермическим и адиабатическим коэффициентами сжатия
и т. п. Из условия, что изолированная система в равновесном состоянии обладает максимальным значением энтропии, вытекает условие минимальности термодинамических потенциалов в равновесном состоянии по отношению к произвольным малым отклонениям от равновесия при фиксированных значениях соответствующих независимых переменных. Это приводит к важным неравенствам (условиям устойчивости), в частности
, cp >
cv > 0
(см.
Устойчивость термодинамическая )
. Третье начало термодинамики. Энтропия определяется согласно 2-му началу Т. дифференциальным соотношением (4), то есть определяется с точностью до постоянного слагаемого, которое хотя и не зависит от температуры, но могло бы быть различным для разных тел в состоянии равновесия. Соответствующие неопределённые слагаемые существуют и у термодинамических потенциалов. В. Нернст (1906) на основе своих электрохимических исследований пришёл к выводу, что эти слагаемые должны быть универсальными: они не зависят от давления, агрегатного состояния и других характеристик вещества. Этот новый, следующий из опыта принцип обычно называется третьим началом термодинамики или тепловой теоремой Нернста. М. Планк (1911) показал, что оно равносильно условию: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения к абсолютному нулю температуры, поскольку универсальную константу в энтропии можно положить равной нулю. Из 3-го начала Т. следует, в частности, что коэффициент теплового расширения, изохорный коэффициент давления
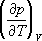
и удельные теплоёмкости
cp и
cv обращаются в нуль при
T ®0. Необходимо отметить, что 3-е начало Т. и вытекающие из него следствия не относятся к системам, находящимся в так называемом заторможенном состоянии. Примером такой системы является смесь веществ, между которыми возможны химические реакции, но они заторможены — скорость реакций при низких температурах очень мала. Другим примером может служить быстро замороженный раствор, который при низкой температуре должен был бы расслоиться на фазы, но процесс расслоения при низких температурах практически не происходит. Такие состояния во многих отношениях подобны равновесным, однако их энтропия не обращается в нуль при
Т = 0
.
Применениетермодинамики . Важными областями применения Т. являются теория равновесия химического и теория фазового равновесия , в частности равновесия между разными агрегатными состояниями и равновесия при расслоении на фазы смесей жидкостей и газов. В этих случаях в процессе установления равновесия существенную роль играет обмен частицами вещества между разными фазами, и при формулировке условий равновесия используется понятие химического потенциала . Постоянство химического потенциала заменяет условие постоянства давления, если жидкость или газ находятся во внешнем поле, например поле тяжести. Методы Т. эффективно применяются при изучении тех явлений природы, в которых существенную роль играют тепловые эффекты. В Т. принято выделять разделы, относящиеся к отдельным наукам и к технике (химическая Т., техническая Т. и т. д.), а также к различным объектам исследования (Т. упругих тел, Т. диэлектриков, магнетиков, сверхпроводников, плазмы, излучения, атмосферы, воды и др.).