У пойкилосмотических животных (морские моллюски, иглокожие) ОД крови меняется параллельно с его изменением во внешней среде. Однако у этих животных имеется клеточная О.: при увеличении ОД крови в клетках на такую же величину возрастает концентрация органических веществ (главным образом аминокислот), для которых клеточная мембрана слабо проницаема. В результате концентрация солей и содержание воды в клетке не меняются, ОД выравнивается за счёт накопления осмотически активных веществ. При уменьшении ОД внешней среды и крови в клетках снижается концентрация органических веществ. Т. о., клеточная О. создаёт условия для ограниченной адаптации пойкилоосмотических животных к колебаниям ОД во внешней среде. См. также Активный транспорт ионов, Водно-солевой обмен, Выделение, Выделительная система, Жажда, лит. при этих статьях и при ст. Осмотическое давление.
Ю. В. Наточин.
Осморегуляция у рыб: пресноводная рыба (1), морская костистая рыба (2); пунктиром обозначено движение воды по осмотическому градиенту. Пресноводные рыбы всасывают соли натрия жабрами; у морских костистых рыб клетки жаберного аппарата выделяют их. Почка морских рыб выделяет соли магния (сульфаты и др.), избыток которых поступает в организм рыб с пищей и морской водой.
Осморецепторы
Осмореце'пторы (от осмос и рецепторы), концевые образования чувствительных нервов, реагирующие на изменение концентрации осмотически активных веществ, т. е. осмотического давления (ОД), в окружающей их жидкости. О. имеются в различных органах и тканях животных (печень, поджелудочная железа и др.). Импульсы от О. поступают в отделы центральной нервной системы, участвующие в регуляции водно-солевого обмена организма (см. также Осморегуляция). Функция осморецепции присуща нервным клеткам т. н. супраоптических ядер гипоталамуса, которые воспринимают даже небольшие колебания ОД плазмы крови (1—2%) и при повышении ОД вырабатывают гормон вазопрессин, накапливающийся в гипофизе. Выделяясь в кровь, этот гормон, обладающий антидиуретическим действием, изменяет проницаемость стенки почечных канальцев, что приводит к уменьшению объёма выделяемой мочи.
Осмос
О'смос (от греч. ōsmós — толчок, давление), диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. О., направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить О., т. е. создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению О. — обратной диффузии растворителя (см. Ультрафильтрация). В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, диффузия последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов. Впервые О. наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие. О. имеет важнейшее значение в биологических процессах (см. Осморегуляция), его широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом «обратного» О. жидкостей.
Лит. см. при ст. Осмотическое давление.
Л. А. Шиц.
Осмотаксис
Осмота'ксис (от осмос и греч. táxis — расположение), свойство растущих органов высших растений (корней, ризоидов), подвижных одноклеточных водорослей, простейших, гамет (в том числе сперматозоидов) ориентироваться или перемещаться в сторону оптимального осмотического давления. Оптимальная для данного вида величина осмотического давления не постоянна и зависит от химической природы субстрата (см. Хемотаксис).
Осмотическое давление
Осмоти'ческое давле'ние, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии (см. Осмос). О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества. О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов» — ионов, молекул, ассоциатов или коллоидных частиц — в единице объёма раствора. Первые измерения О. д. произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с Бойля — Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора. Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n — число молей растворённого вещества в объёме раствора V; R — универсальная газовая постоянная; Т — абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1. О. д. реального раствора (p') всегда выше, чем идеального (p''), причём отношение p'/ p'' = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д. — гипотоническим.
О. д. измеряют с помощью специальных приборов — осмометров. Различают статические и динамические методы измерения. Первый метод основан на определении избыточного гидростатического давления по высоте столба жидкости Н в трубке осмометров (рис.) после установления осмотического равновесия при равенстве внешних давлений pA и рБ в камерах А и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотической ячейки при различных значениях избыточного давления Dp = pA — рБ с последующей интерполяцией полученных данных к n = 0 при Dp = p. Многие осмометры позволяют использовать оба метода. Одна из главных трудностей в измерении О. д. — правильный подбор полупроницаемых мембран. Обычно применяют плёнки из целлофана, природных и синтетических полимеров, пористые керамические и стеклянные перегородки. Учение о методах и технике измерения О. д. называются осмометрией. Основное приложение осмометрии — определение молекулярной массы (М) полимеров. Значения М вычисляют из соотношения
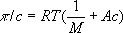
, где
с — концентрация полимера по массе;
А — коэффициент, зависящий от строения макромолекулы.