1) Гелий 2) Натрий.
Эти диаграммы, безусловно, схематичны и не пытаются отобразить орбиты электронов или реальное расположение частиц в деталях.
Я подхожу к конкретным примерам. Но сначала я должен предоставить, в самом маленьком возможном диапазоне, приблизительную схему структуры некоторых типичных атомов. Самый простой пример – атом водорода, у которого в качестве ядра единственный протон (или относительно тяжелая частица с положительным электрическим зарядом), уравновешенный единственным орбитальным электроном (или гораздо менее тяжелой частицей с отрицательным зарядом), который вращается вокруг него много миллионов раз в секунду. Следующий по степени сложности – атом гелия, у которого два орбитальных электрона соответствуют двум ядерным протонам. Кроме того, ядро гелия содержит два нейтрона[41] (незаряженные частицы, чья масса подобна массе протонов); но не они, а, скорее, протоны или единицы с положительным электрическим зарядом, определяют большую часть приоритетов атома и его место в периодической таблице элементов. Та же общая модель наблюдается во всех более тяжелых атомах: при так называемых обычных условиях число периферических электронов – которое может достигать 92 – такое же, как и число центральных протонов, и последние, как правило, связаны с весьма большим числом нейтронов. Неудивительно, что когда число электронов выходит за определенные пределы, некоторые вытесняются, и, как следствие, более тяжелые ядра окружаются несколькими электронными оболочками. У атома натрия, например, три таких оболочки, которые содержат, соответственно, два электрона, восемь электронов и один электрон – всего одиннадцать отрицательно заряженных единиц, которые уравновешиваются одиннадцатью положительно заряженными единицами в ядре атома. Ни у всех оболочек одинаковая вместимость: таким образом, внутренняя оболочка может вместить максимум два, следующая – восемь, третья – восемнадцать, и так далее. Тем не менее, внешняя оболочка никогда не вмещает больше восьми – оставшиеся прибавляются только когда начинается образование новой оболочки. И поведение атома очень сильно зависит от того, сколько электронов содержит эта внешняя оболочка. Когда она наполнена до отказа (вмещая восемь электронов или два – в случае гелия), атом химически инертен, или удовлетворен. С другой стороны, те атомы, у которых только один внешний электрон или им не хватает одного для полной оболочки из восьми, необычайно активны. Таким образом, атом натрия ведет себя так, будто хочет избавиться от своего единственного внешнего электрона, тогда как атом хлора ведет себя так, будто он жаждет получить дополнительный электрон, чтобы прибавить к его семи. Соответственно, когда эти два атома встречаются при подходящих условиях, они удовлетворяют потребности друг друга, объединяя свои силы в виде молекулы хлористого натрия, или обычной соли.
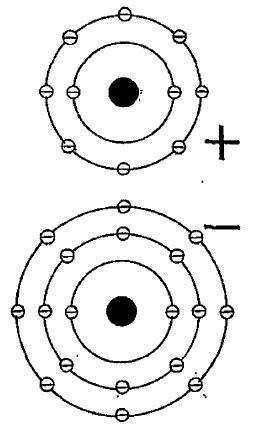
Молекула хлористого натрия. Единственный электрон атома натрия заполняет пустое место во внешней оболочке атома хлора, где он соединяется с электронным партнером с антипараллельным спином. Атом натрия остается соединенным с атомом хлора, т. к. теперь (испытывая недостаток в одном электроне) он имеет положительный заряд, тогда как атом хлора (будучи в полной мере воплотившимся электроном) имеет отрицательный заряд: имея противоположные заряды, они притягивают друг друга.
Вот мы и поговорили об общем распределении частиц, составляющих атом в его обычном состоянии. На самом деле у одного вида атома может быть множество разных состояний. Например, если он находится в звезде или даже здесь на земле, он может быть лишен некоторых или всех его циркулирующих электронов. Также не существует какой-то одной орбиты, по которой может двигаться электрон: когда атом впитывает квант излучения, электрон смещается на более широкую орбиту, а когда квант испущен, электрон вновь проскальзывает обратно. Но число возможных орбит строго ограничено. Все так, будто в пространстве вокруг ядра есть бороздки и электроны могут циркулировать только по ним: гребни между бороздками – своего рода «без-электронная» территория.
Однако на самом деле это описание, хотя и полезное в качестве вступления, не подойдет. На данном этапе необходимо упомянуть один неловкий, но очень важный факт – физик не может в полной мере точно определить поведение электрона. Его трудность в том, что любой эксперимент, при помощи которого обнаруживается электрон, до неопределенной степени его возмущает. (В принципе, возможно описать эксперимент, который позволил бы нам измерить положение электрона или его движущую силу или его кинетическую энергию или его угловой момент; но невозможно описать тот, который бы позволил нам предоставить всю эту информацию об электроне каким он является в данный момент. Определить один размер – значит оставить все остальные неопределенными. Например, пытаясь измерить энергию электрона в определенный момент времени, мы находим, что, измеряя энергию, мы теряем представление о времени, а измеряя время, мы теряем представление об энергии). Один из результатов состоит в том, что больше не существенно говорить о «точном месторасположении и движущей силе электрона в данный момент»: та величина, которая, даже в принципе, не может быть измерена – чудовище, которое лучше забыть[42]. То, что мы можем обсуждать и намереваться определить, это вероятность обнаружить электрон в данном месте в данное время, или вероятность того, что он в данном месте обладает данной движущей силой. Как следствие, если мы вообще хотим представить себе электрон, то мы должны видеть его сливающимся со своей орбитой, а орбиту – как рассредоточенную, или рассеянную. Это правда, что остается заметно выраженная орбита классической теории – но только в качестве обозначения того места, где вероятность обнаружить электрон наибольшая. Мы можем думать, что ядро атома окружено облаками-слоями различной плотности, или системой волн, чем-то похожих на те, что образуются на поверхности пруда, когда в воду бросили камень; главное – рассматривать их как «волны вероятности», а не как физические волны. И к ядру нужно относиться так же: оно заражено той же неопределенностью.
Физик не может точно определить протон или нейтрон. Все, что он может сделать – это выяснить шансы того, что он в определенный момент присутствует именно в этом месте, а не в том.
10. Атом и областная схема: атом водорода
А теперь давайте я расскажу о том, как эта очень странная история о структуре атома согласуется с не менее странным повествованием об областях из предыдущих глав этой книги. Я предлагаю взять рассказ физика о том, что происходит во мне на атомном и субатомном уровне, и, насколько возможно, перевести его на неспециализированный язык, чтобы его можно было сравнить с тем, что происходит во мне на других уровнях. Иначе получится, что мой приближающийся наблюдатель должен потерять память (а то и разум) при входе в каждую новую область и что его описание своего путешествия в целом будет абсолютно невразумительным.
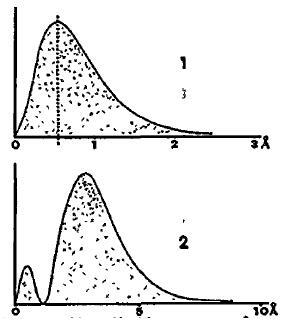
Кривые распределения электрона для 1) обычного состояния атома водорода и 2) одного из его состояний высокого уровня энергии – при разных масштабах. Кривая показывает относительную вероятность обнаружения электрона на разных расстояниях от ядра; таким образом, на схеме (1) электрон больше всего времени проводит на расстоянии 0, 5292 А, чем на любом другом расстоянии. Заметьте, что в состоянии высокого уровня энергии электрон не сходит полностью со своей первоначальной орбиты, однако проводит большую часть времени в стороне.