Рисунок 2. Структура D-ряда углеводов
2. Пиранозные и фуранозные кольцевые структуры.
Альдегидные или кетонные группировки легко реагируют со спиртовыми, образуя полуацетальные или полукетальные группировки, чаще всего это происходит внутри молекулы, и, следовательно, происходит циклизация моносахарида, в результате образуется модифицированный гетероцикл, содержащий атом кислорода. Наиболее устойчивы пяти и шестичленные циклы. Пятичленные циклы углеводов сходны с молекулой фурана, поэтому это фуранозная форма, шестичленные с молекулой пирана – пиранозная форма (Рисунок 3). Все гидроксильные группы, расположенные справа оказываются под циклом, а те что слева – над циклом. Кольцевую структуру могут принимать и кетозы (например, D-фруктофураноза или D-фруктопираноза). В растворе глюкозы более 99% молекул находится в пиранозной форме и менее 1% – в фуранозной форме.
Рисунок 3. Пиранозные и фуранозные формы углеводов
3. α- и β-аномеры. При циклизации образуется гидроксильная группа при полуацетальной или полукетальной группировке, полуацетальный или полукетальный гидроксил, эта группа может располагаться под циклом, в результате образуется α-аномер, а может располагаться над циклом, тогда образуется β-аномер. Циклическая структура сохраняется и в растворе, но при этом происходит образование изомеров относительно положения альдегидного и кетонного атома углерода, что приводит к образованию смеси α – глюкопиранозы (36%) и β – глюкопиранозы (63%); оставшийся 1% представлен в основном α – и β – аномерами глюкофуранозы. Описанное выше установление равновесия сопровождается так называемой мутаротацией: полуацетальное кольцо раскрывается и вновь замыкается, при этом может изменяться положение групп – Н и – ОН при углероде 1. Предполагают, что в ходе этого процесса образуется промежуточная гидратированная линейная (ациклическая) молекула, хотя по данным полярографии на долю ациклической формы глюкозы приходится всего 0,0025%. В растворе глюкоза является правовращающей; этим объясняется еще одно ее название – декстроза (декстро – правый), часто употребляемое в клинической практике (Рисунок 4).
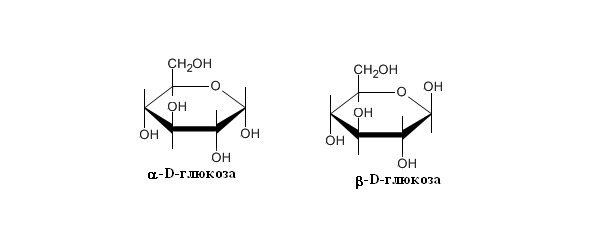
Рисунок 4. Структурные формулы аномеров глюкозы. α- и β-аномеры
4. Эпимеры. Изомеры, различающиеся по конфигурации положением групп – Н и – ОН при асимметричных атомах углерода, которые не связаны с принадлежностью к стереоизомерам, называются эпимерами. Биологически наиболее важными эпимерами глюкозы являются: манноза и галактоза, образующиеся путем эпимеризации при атомах углерода 2 и 4 соответственно (Рисунок 5).
Рисунок 5. Эпимеризация глюкозы
5. Альдо-кето-изомеризация. Фруктоза имеет ту же химическую формулу, что и глюкоза, но отличается по структурной формуле, поскольку фруктоза содержит потенциальную кетонную группу в положении 2, а глюкоза – потенциальную альдегидную группу в положении 1.
Конформация моносахаридов
Шестичленные кольца из одинарных связей, в циклогексане и в сахарах, как правило, принимают конформацию «кресла», как это видно на примере глюкозы (Рисунок 6). Помимо этого, шестичленные кольца могут принимать менее устойчивую конформацию «лодки». Свободно переходят одна в другую через промежуточные скошенные конформации.
Пятичленные кольца образуют конформацию «конверта».
Рисунок 6. Конформация шестичленных колец
Физические свойства моносахаридов
Моносахариды гидрофильны, а, следовательно, легко растворимы в воде. Растворимость моносахаридов примерно одинакова, поэтому разделение моносахаридов достаточно сложно. Моносахариды не поглощают свет ни в видимой, ни в ультрафиолетовой части спектра. Из-за этого нельзя определять концентрацию моносахаридов спектрофотометрическими методами. Так как моносахариды находятся в природе либо в растворе, либо в кристаллах, в физиологических диапазонах температуры нет вопроса о температурах плавления и кипения.
Химические свойства моносахаридов
По своей структуре моносахариды содержат два типа функциональных групп: спиртовые и альдегидные (кетонные), соответственно моносахариды вступают в реакции по этим группам. Моносахариды вступают во многие химические реакции, весьма важные для практического использования и исследования углеводов. Реакции, обсуждаемые в данном разделе, демонстрируют либо наиболее важные свойства углеводов, либо типы реакций, часто встречающиеся в их метаболизме.
Образование эфиров. Это реакция спиртовых групп образуются либо эфиры неорганических кислот, либо органические эфиры (простые со спиртами или галогенидами или сложные с ангидридами кислот). Наиболее активной является полуацетальная спиртовая группа, соответственно она чаще вступает в реакции с образованием эфиров. Эфиры фосфорной и уксусной кислот занимают уникальное место в биохимии и встречаются во многих углеводах и их производных.
Алкилирование (Рисунок 7)
Рисунок 7. Алкилирование
При взаимодействии со спиртами в реакцию вступает только полуацетальная гидроксильная группа, так как спирты слабо активны, поэтому образуется эфир с полуацетальной гидроксильной группой. Галогениды более реакционно способны, поэтому образуют эфиры со всеми свободными группами моносахарида.
Ацилирование (Рисунок 8)
Рисунок 8. Ацилирование
В реакцию образования сложных эфиров вступают спиртовые и карбоксильные группы, но карбоновые кислоты мало реакционно способны поэтому не вступают в реакцию моносахаридами. В реакции ацилирования используют ангидриды карбоновых кислот, их высокая реакционная способность позволяет модифицировать все свободные гидроксильные группы.
Образование эфиров неорганических кислот (Рисунок 9)
Рисунок 9. Образование эфиров неорганических кислот
Неорганические кислоты бывают сильными и слабыми, это объясняет различия их взаимодействия с моносахаридами. Сильные кислоты, например серная, вступают в реакцию с полуацетальной гидроксильной группой, образуя эфир, слабые кислоты вступают в реакцию только после реакции ацилирования, но модифицируют только эфир образованный полуацетальной группой.
Дегидратация. В сильных минеральных кислотах высокой концентрации происходит дегидратация пентоз и гексоз (Рисунок 10). Образовавшиеся фурфурол и оксиметилфурфурол легко полимеризуются; при этом получается коричневая смола. Они также конденсируются с различными фенолами, образуя характерно окрашенные продукты; многие цветные реакции на углеводы основаны на этом свойстве.