3. Белок → ДНК; гипотетический синтез ДНК на белковой матрице. Этот процесс, мягко выражаясь, столь же маловероятен, как и описанный выше. Напомним еще о так называемых стерических несоответствиях — нет никакого сходства между кодоном и аминокислотой, им определяемой. Для того, чтобы информация могла перейти из «кодона в аминокислоту», нужен адаптор, посредник — транспортная РНК, один из концов которой узнает кодон (так называемый антикодон), а другой присоединяет аминокислоту.
Притязания ламаркистов на низвержение «центральной догмы» имели бы смысл, если бы был открыт один из этих трех переносов, но при дополнительном условии: если некий внешний фактор вызовет приспособительное, то есть повышающее шансы на выживание у будущих потомков (!) изменение аминокислотной последовательности белка, а та в свою очередь обусловит соответствующее изменение генома. Ничего подобного не наблюдалось; более того, чем больше мы узнаем о путях генетической информации в клетках, тем менее вероятна возможность подобного открытия. Мнимое поражение «центральной догмы» на деле оборачивается ее подкреплением.
Так что антидогматикам, а точнее — антидарвинистам, уместно вспомнить старую китайскую пословицу: «Если ты очень ждешь друга, не принимай биение своего сердца за стук копыт его коня».
Кто умнее: бактерия или человек?
Учение о направленном, создающем целесообразность влиянии внешней среды дольше всего продержалось в микробиологии, для чего имелись причины.
Микроорганизмы, в частности патогенные бактерии, оказались удивительно изменчивыми и легко приспособлялись к новым факторам. В 1910–1917 годах французский бактериолог Ф. д'Эррель открыл, сначала у коккобацилл саранчи, а затем у дизентерийных бацилл вирусы, которые получили название бактериофагов (теперь их называют для краткости просто фагами). В конце концов фаги были открыты у многих бактерий, и немедленно возникла новая отрасль медицины — фаговая терапия — лечение болезней фагами.
Увы, медиков постигло горькое разочарование. Фаги, сначала активно работавшие, переставали убивать бактерий. Процесс этот понят только сейчас. В основе его лежит давно известный принцип эволюции паразитизма — отбор на нанесение наименьшего вреда хозяину. В самом деле, какая польза паразиту, если он убьет всю популяцию хозяина, — ведь за этим последует его же гибель. Поэтому в самом ходе фаговой терапии автоматически отбираются умеренные, не вызывающие гибель бактерий фаги, от которых в конце концов остается лишь ДНК, встроенная в геном хозяина. Этого мало: бактерии, имеющие в своем геноме такой фаг (профаг, как называл его французский исследователь Андре Львов), становятся лизогенными, то есть они в небольшом количестве выделяют фаги активные, вызывающие растворение, лизис клеток бактерий других штаммов, а сами не заражаются повторно фагами того же штамма. Обоюдная выгода хозяина и паразита! Правда, у этой идиллии было темное пятно: в результате обратной или супрессорной мутации профаг мог возвращаться в активное состояние, уничтожая хозяев поголовно.
Но всю эту хитрую механику, описанную нами весьма и весьма кратко, мы узнали недавно. В 20–30-е годы приспособление бактерий к фагам «по Ламарку» многим казалось несомненным. А оказывается, приспосабливались-то не бактерии, а фаги.
Не менее горьким было разочарование врачей вскоре после внедрения в практику сульфамидных препаратов. Сначала эти препараты (тот же сульфаниламид, известный под названием белого стрептоцида) были весьма действенными, но потом быстро потеряли эффективность против многих видов болезней. Удалось узнать, почему это произошло. Оказалось, что стрептоцид по строению очень похож на парааминобензойную кислоту (ПАБК):
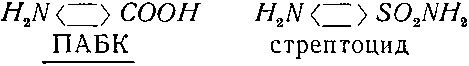
Стрептококки сначала «путали» эти вещества, пытаясь синтезировать из стрептоцида важный витамин — фолиевую кислоту (то, что мы называем витамином В). Но фермент, ответственный за эту реакцию, намертво присоединялся к молекуле стрептоцида, и стрептококк погибал от авитаминоза. Так шло до тех пор, пока не появились устойчивые к стрептоциду штаммы. Их ферменты хорошо «различали» молекулы ПАБК и стрептоцида. Иногда процесс «привыкания» шел иным путем: один из ферментов бактерии становился способным расщеплять вредное вещество, или же повышалась селективность клеточной оболочки, и то же вещество не поступало в клетку.
Третье великое разочарование медицины — антибиотики. Когда в медицинскую практику широко внедрился пенициллин, казалось, что наступила золотая эра победы над болезнетворными бактериями. Пенициллин блокировал рост клеточной оболочки, и бактерия, увеличивая массу, в конце концов лопалась. Но микробы быстро приспособились к антибиотику. На смену пенициллину пришли новые антибиотики с совершенно иным механизмом действия. Микробы опять ответили вспышкой приспособительной изменчивости. Поверженный враг поднимался и снова вступал в борьбу. Этот поединок длится не годы — десятилетия.
Еще один пример: большие надежды возлагали на антибиотик стрептомицин. Стрептомицин, всем вам известный, присоединяется к рибосомам бактерий (не трогая человеческих), отчего они начинают «врать»: считывая информацию с иРНК, синтезируют дефектные белки. Одно время он был очень эффективен, но вскоре появились устойчивые штаммы. Этого мало: возникли и такие, для нормального роста которых стрептомицин был необходим!
Немалую роль в выведении подобных штаммов сыграли невежественные врачи, которые, опасаясь сильного действия, прописывали низкие, сублетальные для микробов дозы, а потом пожимали плечами и говорили, что больной (!) к антибиотику привык. А ведь еще открыватель пенициллина Александр Флеминг писал, что с микробом нужно вести тотальную войну, используя ударные дозы.
Ламаркисты казус приспособительной изменчивости объясняли легко: бактерии приспособительно изменились, потому что в самой природе организмов заложена способность к адаптации — приспособительному, целесообразному изменению. Но исследователи, стоявшие на точке зрения дарвинизма, не сдавались. Все эксперименты по выработке у бактерий устойчивости к фагам, ядам и антибиотикам были нечистыми. Бактерии в благоприятных условиях делятся за 20–30 минут, потомство одной бактерии растет в геометрической прогрессии и за короткий срок насчитывает миллионы и сотни миллионов. Кроме того, бактерии обычно гаплоидны — у них только один генный набор, поэтому любая мутация, даже рецессивная, немедленно проявляется в потомстве. Устойчивость может возникнуть случайно, в результате мутации, а при таком темпе размножения отбор быстро уничтожает прежний, «дикий» тип и сохраняет мутантов. Для того чтобы сделать выбор между ламаркизмом и дарвинизмом, нужен был чистый эксперимент, в котором можно было оценить роль отбора и прямого приспособления.
Два блестящих по красоте опыта раз и навсегда разрешили спор между дарвинистами и ламаркистами в микробиологии. Пожалуй, только в физике эксперимент решал однозначно вопросы столь капитальной важности, лежащие в основе всего современного естествознания.
Начнем с так называемого флуктуационного эксперимента М. Дельбрюка[11] и С. Лурии, поставленного более 25 лет назад. В нем восхищает строго математический подход к решению задачи.
Дельбрюк и Лурия рассуждали так: возьмем ряд пробирок с жидкой средой и засеем каждую из них небольшим количеством бактерий. Срок деления их при комнатной температуре около часа. Через час из 100 бактерий получается 200, через 2–400, через 10 — более 10 000. Когда бактерии достаточно размножатся, возьмем из каждой пробирки ряд проб и посеем их в чашки Петри на агар, содержащий антибиотик. Бактерии, неприспособленные к антибиотику, погибнут. Каждая устойчивая, как говорят микробиологи, резистентная клетка даст начало колонии, видной невооруженным глазом.
Если прав Ламарк и резистентность возникает у бактерий в результате приспособительной реакции на антибиотик, вероятность возникновения резистентных колоний будет одинакова в пробах из одной пробирки и из разных пробирок. Вероятность эту можно подсчитать — она должна распределяться согласно закону Пуассона. Пуассоново распределение отличается одним характерным свойством: у него среднее число равно дисперсии — величине, показывающей отклонение от среднего.