Еще в 1909 году датский химик Сёренсон первым указал на исключительное влияние ионов водорода на биологические реакции. Он же первым предложил оценивать кислотность растворов не по истинной концентрации ионов водорода в растворе, а по величине рН.
Для чего нам нужны ионы водорода?
На этот вопрос мы уже частично ответили: при снижении концентрации ионов водорода в крови (при повышении рН крови) повышается сродство кислорода с гемоглобином, в результате чего организм начинает испытывать гипоксию. Но не только для этого организму нужны ионы водорода.
Наш организм состоит из множества клеток. Клетка – это самая элементарная единица, способная поддерживать жизнь, но в то же время она представляет собой весьма сложный объект. Клетка – это отдельный микромир, имеющий четкие границы, внутри которых существуют непрерывная химическая активность и непрерывный поток энергии. Клетка имеет наружную мембрану, главная функция которой состоит в регулировании обмена различных веществ между клеткой и внешней средой.
Внутри клетка также с помощью мембран поделена на отдельные отсеки (компартменты). И чем, прежде всего, для нас интересны в данный момент эти отсеки, так это разной концентрацией ионов водорода в каждом из них. То есть в каждом отсеке поддерживается не только кислая среда, но и с различной величиной рН, иногда ниже 4 единиц.
А какую роль выполняют ионы водорода в клетке, говорится и в 10-й главе (об атеросклерозе), и чуть ниже («АТФ – универсальное клеточное горючее»). А чтобы создавать такие повышенные концентрации ионов водорода в отсеках, в каждой мембране имеются механизмы активного переноса ионов водорода из внеклеточной среды в эти отсеки, которые называются протонными помпами. Напомню здесь, что ионы водорода – это и есть в чистом виде протоны. А чтобы протонные помпы могли перекачивать ионы водорода, нужны по крайней мере сами эти ионы, а проще говоря, нужна подкисленная межклеточная среда, а такую среду может создать только подкисленная кровь. Так мы опосредованно пришли к выводу, что кровь обязательно должна содержать в себе достаточную концентрацию ионов водорода.
Но сама по себе концентрация ионов водорода еще не дает нам полной наглядной информации о достаточности или недостаточности этих ионов в крови. Поэтому более информативным для нас будет соотношение Н+ и ОН- при различных значениях рН.
Здесь мы остановимся на четырех реакциях крови, которые ситуативно могут быть у нас, и посмотрим, как отношение Н+/ОН- может сказываться на нашем здоровье. Реакции эти равны 6,0, 6,9, 7,4 и 8,0.
Если мы считаем, что реакция крови с рН = 7,4 является нормальной реакцией для нашей артериальной крови, тогда следует считать нормальным и такое отношение Н+/ОН-, когда на один ион водорода приходится шесть гидроксид-ионов. При такой реакции крови мы если и не постоянно, то довольно часто болеем.
Но если эту реакцию крови (рН = 7,4), которую мы в настоящее время считаем нормальной, повысить всего на 0,6 единицы, то получим алкалоз (рН = 8,0) – значительное повышение щелочных компонентов в крови. А это не только очень болезненное состояние организма, но и почти безжизненное. А отношение Н+/ОН- при этом будет выглядеть как один к ста. Как видим, и при достаточно щелочной реакции крови (рН = 8) в ней еще имеются ионы водорода, но каждый из них находится в «густом лесу», состоящем из ионов ОН-. Легко ли при таком соотношении ионов водорода и гидроксид-ионов протонным помпам найти и перенести внутрь клетки необходимое число протонов? Такой поиск можно сравнить только с поиском иглы в стоге сена. То есть при таком соотношении между Н+ и ОН- протонные помпы просто не в состоянии будут найти в крови и перекачать внутрь клетки ионы водорода, хотя эти ионы и будут находиться в крови. И в результате мы будем постоянно болеть. И это всего лишь при незначительном сдвиге реакции крови в сторону повышения рН.
А теперь понизим рН крови (повысим концентрацию ионов водорода в ней) относительно так называемой нормальной ее реакции (относительно рН = 7,4) всего лишь на 0,5 единицы. Мы получим оптимальную реакцию крови. При такой реакции крови (при рН = 6,9) наступает оздоровление организма. А отношение Н+/ОН- при этом будет равно 5/3, а при рН = 7,4 это отношение было равно 5/30. И абсолютное число ионов водорода при переходе от рН = 7,4 к рН = 6,9 увеличивается в три раза. Ионов водорода, таким образом, становится достаточно для нормального функционирования всех систем организма.
Как видим, при незначительном и почти равном сдвиге реакции крови в одну и в другую сторону относительно постоянно имеющейся у нас реакции крови (относительно рН = 7,4), происходят очень большие изменения концентрации ионов водорода и гидроксид-ионов в крови, что незамедлительно сказывается на нашем здоровье.
Если мы продолжим подкисливать кровь, ее реакция может понизиться до рН = 6,0. По медицинской терминологии это уже ацидоз, то есть повышенно кислая кровь. При такой реакции крови отношение Н+/ОН- равно 100 к 1. И если при рН = 8,0 человек становится очень больным, то при рН = 6,0 может происходить интенсивное оздоровление организма человека (такое состояние бывает при оздоровительном беге, когда кровь подкисливается молочной кислотой). Уже одно такое краткое сравнение состояний нашего организма при четырех разных, но реальных для нас реакциях крови, говорит нам о большом влиянии концентрации ионов водорода в крови на наше здоровье.
Нам всегда следует помнить и об эффекте Вериго-Бора, согласно которому с увеличением кислотности крови (с увеличением в ней концентрации ионов водорода) уменьшается связь оксигемоглобина с кислородом, и таким образом улучшается снабжение организма кислородом (хотя этот эффект был выражен его авторами в несколько иной интерпретации). Наглядно эта ситуация представлена на рисунке 3.
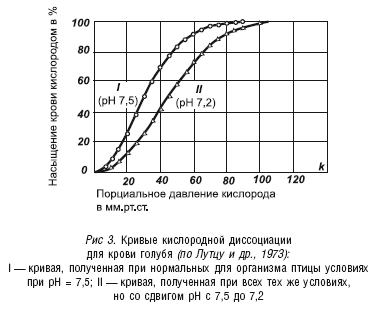
На рисунке 3 изображены две кривые кислородной диссоциации, которые получены для одной и той же крови при нормальных условиях по парциальному давлению, но при разных значениях рН крови. Первое, на что следует обратить внимание при анализе рисунка 3, – это на то обстоятельство, что при различных значениях рН полное насыщение крови кислородом происходит при значительно меньшем парциальном давлении кислорода, чем оно реально существует на уровне моря или просто на равнинной местности. А это означает, что нас не должна особенно волновать проблема насыщения нашей крови кислородом, по сути, мы всегда имеем полное насыщение крови кислородом, если только мы не живем высоко в горах. А вот другая проблема – отдача кислорода тканям – нас должна особенно беспокоить. Очень часто наша кровь возвращается в легкие, не истратив даже 50 % запасенного в ней кислорода. И в таком случае нам может помочь эффект Вериго-Бора. Например, при парциальном давлении кислорода в крови равном 40 мм рт. ст. с рН = 7,2 (по рис. 3) кровь может отдать 60 % связанного кислорода, но та же кровь с рН = 7,5 – только 30 %. Ясно, что для организма более благоприятна кровь с рН = 7,2, чем с рН = 7,5.
АТФ – универсальное клеточное горючее
И снова мы возвращаемся к энергетике клетки. Вспомним, что клетка – это отдельный микромир, имеющий четкие границы, внутри которых существуют непрерывная химическая активность и непрерывный поток энергии. В переносе энергии от энергодающих химических реакций к процессам, идущим с потреблением энергии (которые собственно и составляют работу клетки), принимает участие АТФ (аденозинтрифосфат), выполняющий очень важную роль носителя энергии в биологических системах.
Как же образуется универсальное клеточное горючее – знаменитый АТФ?