Для молекулы воды H2 O можно записать следующую валентную структуру:
Атом кислорода окружен двумя неподелёнными парами электронов и двумя поделенными парами. 2s -Орбиталь несколько более стабильна, нежели 2р -орбитали, так что неподелённые электронные пары прежде всего заполняют 2s -орбиталь. Если бы две связи в молекуле воды были образованы р -орбиталями атома кислорода, то угол между связями был бы равен 90°, поскольку при угле 90° друг относительно друга р -орбитали имеют максимальную силу связи. Расчёты показывают, что максимальная устойчивость достигается в том случае, когда орбитали, образующие связи в молекуле воды, в небольшой мере имеют также s -характер, соответственно валентный угол между связями несколько больший, чем 90°. Экспериментальное значение валентного угла в молекуле H2 O 104,5°, а валентные углы в гидридах H2 S, H2 Se и H2 Te равны 92, 91 и 90° соответственно.
Двойная ковалентная связь между атомами углерода имеется в этилене C2 H4 , а тройная связь — в ацетилене C2 H2 . Валентные структуры для этих молекул следующие:
В образовании двойной связи участвуют две поделенные электронные пары, а в образовании тройной связи — три пары. В каждой из этих структур атом углерода приобретает электронную конфигурацию неона, будучи окружен четырьмя поделенными парами электронов. Можно сказать, что атом углерода образует четыре одинарные (ординарные, простые) связи, направленные к вершинам тетраэдра. В двойной и тройной связях имеются две или три изогнутые связи. Интересно, что в этих случаях расстояния между атомами углерода равны соответственно 133 пм и 120 пм , что с точностью до 1 пм совпадает со значениями, соответствующими изогнутым связям при нормальной длине одинарной связи 154 пм в молекуле этана. Такое соответствие подтверждает правильность представления, что двойная и тройная связи могут быть описаны моделью изогнутых связей.
Энергия двойной углерод-углеродной связи на 73 кдж ×моль-1 меньше, чем сумма энергий двух одинарных связей, энергия же тройной связи на 220 кдж ×моль-1 меньше суммы энергий трёх одинарных связей. Эти различия в устойчивости могут быть связаны с напряжённостью изогнутых связей. Энергия напряжения благоприятствует превращению кратных связей в одинарные, и именно поэтому вещества с кратными связями легко присоединяют водород; такие вещества принято называть ненасыщенными, а соответствующие соединения, имеющие только одинарные связи, например этан, называются насыщенными.
Резонанс и структура бензола. Правила построения валентных структур на основании представлений о поделенных парах электронов и использования устойчивой орбитали каждого из двух атомов, между которыми образуется ковалентная связь, позволяют написать структурные формулы для очень большого числа веществ, однако для некоторых веществ одна валентная структура не даёт вполне адекватного представления о свойствах. Веществом именно такого рода является, например, озон O3 . Спектроскопические исследования озона показали, что атомы в его молекуле расположены под углом 117° (угол между связями у центрального атома кислорода), а каждая из двух связей кислород — кислород имеет длину 128 пм. Есть все основания приписать молекуле озона следующую валентную структуру:
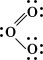
Эта структура представляется удовлетворительной, поскольку каждый из атомов кислорода окружен четырьмя парами электронов, причём некоторые пары поделенные, а некоторые неподелённые. Однако если приписать формальные заряды атомам, разделив поделенные пары электронов поровну между двумя атомами, то центральный атом будет иметь положительный заряд, а атом, связанный с ним одинарной связью, — отрицательный. Такую электронную структуру нельзя считать вполне удовлетворительной, поскольку межатомное расстояние, отвечающее двойной связи, должно быть приблизительно на 21 пм меньше, чем расстояние для одинарной связи, тогда как согласно наблюдениям эти расстояния равны. Такое расхождение можно объяснить, приняв и вторую валентную структуру для данной молекулы:
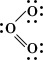
Приведённые структуры эквивалентны. При квантовомеханическом рассмотрении молекулы озона ей приписывается волновая функция, которая представляет собой сумму волновых функций для этих двух валентных структур. Установлено, что подобная волновая функция отвечает среднему значению длины связи, одному и тому же для обеих связей, и, кроме того, эта волновая функция соответствует большей стабильности, нежели каждая из волновых функций отдельных валентных структур. Такая дополнительная стабилизация описывается как энергия резонанса, соответствующая резонансу молекулы между двумя структурами. Отсюда следует, что озон нельзя удовлетворительно описать одной валентной структурой обычного типа, тогда как комбинация двух валентных структур приводит к удовлетворительному описанию молекулы в её основном состоянии.
Этот факт не противоречит основному принципу, выдвинутому в 1861 Бутлеровым, — каждое вещество имеет определённое молекулярное строение, которое обусловливает свойства данного вещества (см. Химического строения теория , Электронные теории в органической химии ). Молекула озона в её основном состоянии имеет определённое единственное строение. Оно может быть представлено одной формулой:
Стрелки в этой формуле показывают, что двойная связь и одинарная связь могут меняться местами. Структура с двойной связью в одном положении и одинарной связью в другом не представляет какого-либо состояния молекулы озона, однако две резонирующие валентные структуры вместе взятые или структурная формула, в которой символически показано, что двойная и одинарная связи меняются местами, дают приемлемое представление о действительном единственном строении молекулы озона в основном состоянии.
Аналогичная ситуация наблюдается при рассмотрении молекулы бензола, строение которой казалось химикам загадочным до разработки (1928—33) теории резонанса (называемая также мезомерией). Кекуле указывал, что четырёхвалентность углерода в бензоле можно показать с помощью структурной формулы с чередующимися простыми и двойными связями. Однако таких структур может быть две:
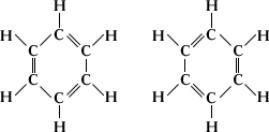
Были предприняты попытки обнаружить изомеры таких веществ, как о -дихлорбензол (атомы хлора присоединены к атомам углерода, связанным двойной связью в случае первого изомера и одинарной связью в случае второго). Однако обнаружить такие изомеры не удалось, и было признано, что все шесть углерод-углеродных связей в бензольном кольце эквивалентны друг другу. Детальное квантовомеханическое рассмотрение бензола показало. что его молекула имеет гексагональную симметрию и что все шесть углерод-углеродных связей эквивалентны. Этот факт позволяет сказать, что основное состояние молекулы бензола может быть представлено двумя структурами Кекуле, налагающимися одна на другую или резонирующими между собой. В соответствии с квантовомеханическими расчётами реальная молекула бензола должна быть приблизительно на 150 кдж ×моль-1 устойчивее, нежели гипотетическая молекула, описываемая лишь одной структурой Кекуле. Эта дополнительная устойчивость обусловливает повышенную сопротивляемость бензола гидрогенизации по сравнению с обычными ненасыщенными соединениями.