В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см. Межмолекулярное взаимодействие ). Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчёта коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведённой температуры T* = kT/e . Эта температура характеризует отношение кинетической энергии молекул (~kT ) к их потенциальной энергии (e — глубина потенциальной ямы при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г . При повышении плотности изменяются свойства Г., они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г. становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г. пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г. от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны — сил отталкивания, препятствующих безграничному сжатию Г. (см. Ван-дер-Ваальса уравнение ).
К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критической точки, относится вириальное уравнение состояния :
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
В Г. малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэффициента В . В соответствии с температурным изменением В , при т. н. температуре Бойля ТВ (см. Бойля точка ) В обращается в нуль, и умеренно плотный Г. ведёт себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г. Внутренняя энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
С межмолекулярным взаимодействие связано также изменение температуры реального Г. при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется дросселированием ). Мерой изменения температуры Г при дросселировании служит Джоуля — Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. температуре инверсии (см. Джоуля — Томсона явление ). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Внутреннее строение молекул Г. слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Г. Напротив, калорические свойства Г. (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) iвн . В соответствии с равнораспределения законом классической статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная 1 /2 · kT . Отсюда теплоёмкость 1 моля
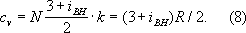
Для точного расчёта калорических свойств Г. необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10—22 тыс. градусов.
Электрические свойства Г. связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Г. электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается. Зависимость электропроводности Г. от различных физических факторов рассмотрена в ст. Электрический разряд в газах .
При температурах начиная с нескольких тыс. градусов всякий Г. частично ионизуется и превращается в плазму . Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного Г.
По магнитным свойствам Г. делятся на диамагнитные (к ним относятся, например, инертные газы, H2 , N2 , CO2 , H2 O) и парамагнитные (например, O2 ). Диамагнитны те Г., молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля (см. Диамагнетизм ). Те же Г., у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. Парамагнетизм ). Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см. Газовая динамика , Аэродинамика разреженных газов ).
В современной физике Г. называют не только одно из агрегатных состояний вещества. К Г. с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный Г.), фононов в жидком гелии (фононный Г.) и т. д. Г. элементарных частиц и квазичастиц обладающих целым спином , т. н. бозонов (например, фотонов, p-мезонов, фононов), называется бозе-газом. Его свойства рассматривает квантовая статистика Бозе — Эйнштейна. Свойства частиц Г. с полуцелым спином — фермионов (например, электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика Ферми — Дирака (см. Статистическая физика ).
Физические свойства газов
| Свойства газов | Азот N2 | Аргон Ar | Водород H2 | Воздух | Кислород O2 | Углекислый газ CO2 |
| Масса 1 моля (г) | 28,02 | 39,94 | 2,016 | 28,96 | 32,00 | 44,00 |
| Плотность при 0°C и 1 ат * (кг/м3 ) | 1,2506 | 1,7839 | 0,0899 | 1,2928 | 1,4290 | 1,976 |
| Теплоемкость при постоянном объеме сv и 0°C (кдж/моль •град ) | 20,85 | 12,48 | 20,35 | 20,81 | 20,89 | 30,62 (55°C) |
| Скорость звука при 0°C (м/сек ) | 333,6 | 319 | 1286 | 331,5 | 314,8 | 260,3 |
| Вязкость h при 0°C (h•106н •сек /м2 ) | 16,6 | 21,2 | 8,4 | 17,1 | 19,2 | 13,8 |
| Теплопроводность l при 0°C (l•102 дж/м •сек •град) | 2,43 | 1,62 | 16,84 | 2,41 | 2,44 | 1,45 |
| Диэлектрическая проницаемость e при 0°C и 1 ат* | 1,000588 | 1,000536 | 1,000272 | 1,000590 | 1,000531 | 1,000988 |
| Удельная магнитная восприимчивость c при 20°C (c•106 на 1 г ) | -0,43 | -0,49 | -1,99 | — | +107,8 | 0,48 |