Белковые и липидные паттерны связаны и с темой предсказуемой случайности. Текучесть мембран позволяет их компонентам перегруппировываться, но привносит факторы неопределенности потока и неупорядоченности. Ни человек, ни клетка не способны знать наперед, где именно окажется каждый липид или белок, но мы можем прогнозировать усредненно свойства целого ансамбля. Глубинную природу случайности и смысл предсказаний прояснит нам шестая глава.
Конусы, сферы и пузыри
Бислой – не единственная структура, которую могут создавать амфифильные молекулы. Представьте молекулу в форме рожка с мороженым, где шарик мороженого – гидрофильная часть, а палочка – гидрофобная (слева на рисунке). В воде такие молекулы самостоятельно соберутся в сферу, чтобы защитить свои гидрофобные части (справа).
Форма молекулы – ключевой определяющий фактор в самосборке. Большинство липидов в вашем организме скорее цилиндрические, чем конические – их гидрофильные головки и гидрофобные хвосты сопоставимы по ширине, – как раз потому они и группируются в относительно плоский бислой. И все же у небольшой доли клеточных липидов форма отличается от цилиндрической – не настолько, чтобы воспрепятствовать образованию бислоя, но достаточно, чтобы обеспечить изгибание мембраны в сложные структуры.
Вам, возможно, интересно, могут ли амфифилы выстраиваться так, чтобы гидрофильные головки оказывались внутри, а гидрофобные хвосты – снаружи. Да, могут, и вы создаете такие структуры всякий раз, когда пускаете мыльные пузыри.
В оболочке пузыря молекулы мыла выстраиваются по обе стороны от тонкой водной пленки гидрофобными хвостами наружу, к воздуху. На глубинном уровне мыльные пленки и клеточные мембраны схожи – не забывайте об этом, когда моете посуду.
Туберкулез и плотные мембраны
В начале XIX века 30 % смертей в Лондоне вызывал туберкулез4, инфекционное заболевание, которое чаще всего поражает легкие. «Белая чума» поражала и убивала множество людей по всему миру и в первые полтора десятилетия XX века по-прежнему не покидала две верхние строки в списке главных причин смерти в США5. Даже сейчас от туберкулеза умирает около миллиона человек в год6. Эту болезнь вызывает бактерия Mycobacterium tuberculosis. Другая микобактерия, Mycobacterium leprae, вызывает лепру, или проказу, еще один бич человечества, тысячелетиями разъедавший кожу и нервную систему своих жертв, пока не появились современные антибиотики. Микобактерии отличаются потрясающей живучестью. Уже лет 100 мы знаем, например, что M. leprae и M. tuberculosis могут многими месяцами обходиться без воды7. Это озадачивает не только потому, что биохимическая активность клетки немыслима без воды. Если гидрофильные головки липидов не контактируют с водой, то как гидрофильным и гидрофобным взаимодействиям сохранять целостность мембраны и как мембране сохранять целостность бактерии?
Оказывается, у микобактерий очень странные мембраны. Как и у клеток всех остальных организмов, их внутренности ограничены липидным бислоем. Однако снаружи этот бислой покрыт густым гидрофобным гелем, над которым находится еще и монослой липидов, маслянистые хвосты которых направлены внутрь, а гидрофильные головки – наружу. Необычно здесь не только расположение липидов, но и их устройство: у многих молекул к гидрофильным головкам прикреплен сахар трегалоза (на рисунке на него указывает стрелка). Насколько мы знаем, микобактерии и некоторые их близкие родственники – единственные на планете организмы, наделенные трегалозными липидами. Но так ли это важно?
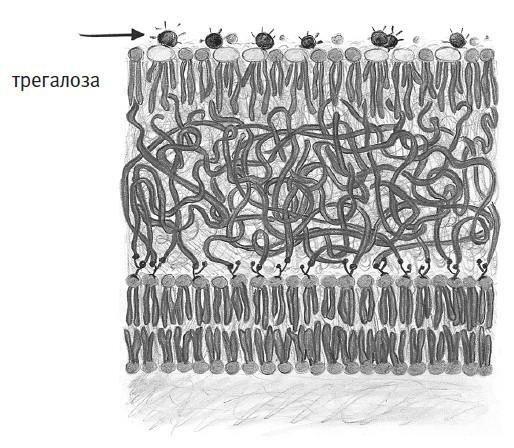
Я узнал об этих микобактериальных мембранах лет десять назад, вскоре после того, как основал свою исследовательскую лабораторию в Орегонском университете. К тому времени я уже несколько лет работал с липидными бислоями, в основном измеряя их жесткость и прочие физические свойства, чтобы понять, на что способны эти материалы. Экспериментируя с сахарами и полимерами, я скооперировался с группой химика Каролин Бертоцци, которая тогда работала в Калифорнийском университете в Беркли. По совпадению они тогда интенсивно изучали, как микобактерии создают трегалозные липиды и другие странные молекулы: группа Бертоцци хотела разобраться в выдуманных природой химических инструментах и научиться выводить их из строя, чтобы побеждать болезни. Именно в ходе этого сотрудничества я впервые услышал о трегалозных липидах и сразу же заинтересовался ими, поскольку трегалоза в иных контекстах слыла чуть ли не волшебным сахаром.
Лишь небольшое число организмов, включая некоторые грибы, растения и даже отдельных животных, способны пережить потерю 99 % воды. Так, «воскресающее растение» плаунок чешуелистный (Selaginella lepidophylla) годами выдерживает почти полную дегидратацию, сворачиваясь в плотный коричневатый шарик, который при поступлении воды «оживает», расправляясь в обычную зеленую розетку листьев. У многих из этих организмов есть кое-что общее: они производят трегалозу, часто в огромных количествах. В сравнении с сахарами вроде знакомых нам глюкозы или сахарозы трегалоза менее склонна кристаллизоваться с ростом концентрации, благодаря чему ее молекулам проще взаимодействовать с другими веществами. Кроме того, трегалоза легко формирует водородные связи – те, что скрепляют молекулы воды друг с другом и с разными гидрофильными молекулами: это позволяет сахару в некоторой степени имитировать воду. Но трегалоза, в отличие от воды, не склонна к испарению. Считается, что все эти свойства делают трегалозу фактором устойчивости к иссушению, и ученые ищут способы использовать ее вне организма – чтобы хранить и транспортировать в высушенном состоянии вакцины и биоматериалы типа клеток крови и ценных белков8. Я задумался: а не приспособили ли микобактерии трегалозный инструментарий в связке с липидами для защиты своей клеточной оболочки от обезвоживания? И как же проверить эту гипотезу?
Нельзя было просто отключить у микробов производство трегалозных липидов, а затем проверять их на прочность: о подобных биохимических механизмах микобактерий мы знаем слишком мало, чтобы их менять. Но даже если бы это было в наших силах, я не горел желанием держать в лаборатории возбудителя туберкулеза. (Как мы позже узнаем, моя группа с удовольствием работала с холерными вибрионами, но холеру легко предупредить, сложно подхватить, просто излечить – в отличие от туберкулеза.) Я выбрал другой подход, который уже десятки лет успешно работал с «нормальными» липидными бислоями: воссоздание искусственных бесклеточных мембран на твердых поверхностях. Обычные липиды можно подтолкнуть к формированию бислоев на очень чистых и ровных стеклах.