Этот удивительный процесс был потрясающе снят на видео исследователями Токийского университета Хироси Нисимасу и Осаму Нуреки в 2017 г. Используя метод, называемый высокоскоростной атомно-силовой микроскопией, они смогли увеличить изображение в тот самый момент, когда Cas9 захватывала молекулу ДНК. В фильме Cas9 выглядит как позолоченный камень, когда она останавливается на несколько секунд на нити ДНК, прежде чем разрубить ее пополам[76]. После того как Нисимасу выложил это видео в своем аккаунте Twitter, оно стало вирусным и было показано по японскому телевидению.
Однако сориентировать Cas9, чтобы она искала конкретную уникальную последовательность в геноме человека, – это в миллионы раз сложнее, чем разрезать вирусную ДНК. Когда комплекс Cas9 входит в чужеродное пространство клеточного ядра, она сталкивается с лабиринтом ДНК – двадцатью тремя парами хромосом, шестью миллиардами букв ДНК (сравним со стандартным геномом фага, состоящим всего из нескольких тысяч оснований). Попадая в ядро, каждая молекула Cas9 обыскивает плотно упакованные спирали ДНК, чтобы найти последовательности PAM, которые встречаются в среднем один раз за каждый полный оборот двойной спирали на 360 градусов, то есть на 10 нуклеотидов. В целом фермент должен «опросить» 300–400 млн оснований, чтобы определить точную мишень для направляющей РНК, которая сама состоит почти из 20 нуклеотидов.
Йохан Эльф, биофизик из Уппсальского университета в Швеции, подсчитал, что Cas9 обычно требуется около шести часов для обнаружения каждой последовательности PAM в бактериальном геноме с остановками на двадцать миллисекунд на каждом предполагаемом участке, чтобы заглянуть в двойную спираль и проверить, действительно ли он нашел правильную мишень[77]. Но упаковка ДНК в ядре эукариотической клетки намного сложнее, чем у бактерий. Во время лекций, проводимых для студентов в Эдинбургском университете, Эндрю Вуд показывает схему строения бактериальной клетки рядом с извилистым петляющим волокном ДНК млекопитающих. «Cas9 не создана для того, чтобы работать в той среде, в которую мы сейчас ее поместили, – говорит он. – Поразительно, что она способна рассмотреть сотни миллионов нуклеотидов за считаные часы»[78].
После того как Cas9 разрезал ДНК, репаративные ферменты ДНК клетки «зашивают» разрыв. Эксперты удивляются тому, как успешно это работает[79]. Cas9 превосходит даже ранее разработанные технологии редактирования генов ZFN и TALEN[80]. «Они были созданы, чтобы работать с эукариотической ДНК, но тем не менее, по всей видимости, Cas9 превосходит их», – говорит Вуд.
Давайте сделаем паузу и отметим решающую роль, которую играет в этом процессе последовательность PAM: поиск коротких фрагментов PAM вместо распаковки и проверки практически всего генома значительно упрощает задачу для Cas9 по фиксации целевой последовательности. Наличие PAM также объясняет то, что Cas9 не разрезает случайным образом повторы в последовательности CRISPR бактериальной ДНК. Это связано с тем, что, когда последовательности ДНК изначально добавляются к участку CRISPR в геноме бактерий, последовательности PAM отсекаются. Генные инженеры не хотят ограничиваться природным набором последовательностей PAM, поэтому модифицируют исходные ферменты Cas9 и Cas других видов бактерий, чтобы расширить их предпочтения в распознавании короткой последовательности PAM.
Если у бактерий настолько эффективна система безопасности, было бы резонно задаться вопросом: почему вирусы не вымерли? Вирусы незаметно развили множество обходных механизмов – группу белков, которые способны нейтрализовать нуклеазы Cas, известные как белки анти-CRISPR. Вирусы и бактерии подобны хищникам и их жертвам, вовлеченным в бесконечную борьбу, которая продолжается сотни миллионов лет[81]. CRISPR обнаружен в 46 % бактериальных геномов и почти во всех геномах архей, но, что удивительно, совсем не встречается в геномах высших организмов. Хотя на сегодняшний день Cas9 чаще всего используется совместно с CRISPR, являясь предметом ожесточенных патентных споров, о которых я расскажу позже, этот фермент представляет собой лишь каплю в море разнообразных систем CRISPR, встречающихся в природе. Ученые прикладывают массу усилий, чтобы изучить биологическое разнообразие на Земле, открыть новые белки семейства Cas с новыми функциями и расширить набор инструментов CRISPR[82].
После того как исследователь определил последовательность гена, на которую он хочет воздействовать, он может перейти на любое количество веб-сайтов, ввести желаемый генетический текст и заказать индивидуально подобранную короткую последовательность направляющей РНК. Если CRISPR – это молекулярная система работы с текстами, то направляющая РНК действует как функция CTRL + F, выявляющая интересующие последовательности генов. Работа Cas9 подобна нажатию клавиш CTRL + X. Однако редактирование генома – это не просто наведение курсора для выделения и удаления опечатки. Речь идет о том, чтобы решить, что будет дальше и как этим управлять, как исправить опечатку.
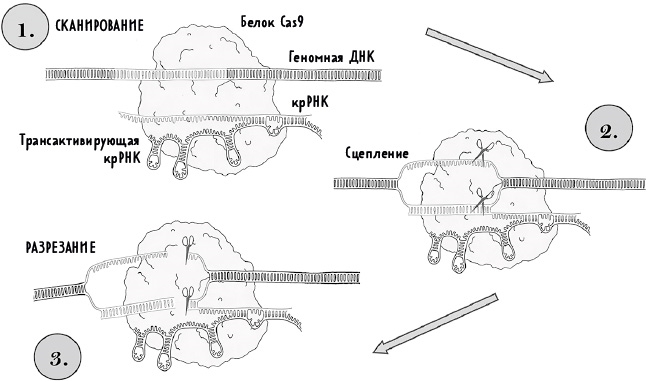
Разрезание ДНК при помощи CRISPR. 1. Сканирование: нуклеаза Cas9 связывается с направляющей РНК, образуя рибонуклеопротеидный комплекс. Направляющая состоит из крРНК и трансактивирующей крРНК. Комплекс Cas9 сканирует ДНК в поисках последовательности PAM, которая служит первичным сигналом для проверки совпадения последовательностей. 2. Сцепление: Cas9 связывается с ДНК и расщепляет двойную спираль, позволяя крРНК комплементарно (взаимодополняюще) присоединиться к одной нити ДНК. 3. Разрезание: если ДНК и РНК полностью совпадают, Cas9 претерпевает конформационное изменение, в результате чего обе нити ДНК разрезаются в одном и том же месте. (По материалам пункта 23 примечаний.)
Клетки обладают множеством молекулярных механизмов восстановления разрывов и других мутаций в ДНК. Если бы их не было, нас бы не было в живых. Два наиболее известных механизма называются негомологичным соединением концов (NHEJ) и гомологически направленной репарацией (HDR). NHEJ небрежно сшивает вместе разорванные концы ДНК, что часто приводит к небольшим вставкам или делециям генетического текста в месте восстановления. Это идеально подходит для исследователей, использующих CRISPR для преднамеренного нарушения функции гена путем его нарушения с помощью добавления случайных вставок и делеций. Другой механизм, HDR, при наличии подходящей матрицы производит надежное восстановление. В нормальных условиях матрицей является соответствующий ген на сестринской хромосоме. Прелесть редактирования генома при помощи CRISPR заключается в том, что исследователь может предоставить подходящую матрицу, содержащую желаемую последовательность для восстановления разрыва, вызванного Cas9, что приводит к нужному изменению в определенном месте молекулы ДНК[83][84].
В январе 2020 г. около пятисот ученых собрались в Банфе, горнолыжном курорте на юге канадских Скалистых гор, чтобы провести первую большую конференцию года, посвященную CRISPR. (Она также оказалась и последней, поскольку пандемия COVID-19 лишила желающих возможности ездить на подобные мероприятия.) Организаторы пригласили Дудну выступить с речью на открытии, состоявшемся воскресным утром, – к этой роли она уже привыкла. Она начала с искренних извинений за то, что не сможет остаться и пообщаться с участниками в течение следующих нескольких дней, поскольку ей было необходимо вернуться в Беркли, чтобы в понедельник утром прочитать лекцию для шестисот студентов.