Получив оба промежуточных продукта, мы тем самым осуществили самую трудную часть синтеза. Теперь, чтобы получить само лекарство, осталось лишь смешать оба вещества, но обязательно в растворенном состоянии и при нагревании. В двух химических стаканах (на 100 и 250 мл соответственно) растворим 5 г ангидрометиленлимонной кислоты в 20 мл спирта и 3,5 г гексаметилентетрамина в 30 мл спирта. Для растворения оба стакана одновременно нагреем на водяной бане приблизительно до 80 °C. Затем горячий раствор ангидрометиленлимонной кислоты быстро выльем в большой стакан с раствором гексаметилентетрамина. При этом будем как можно энергичнее перемешивать смесь стеклянной палочкой. Лекарственный препарат выпадает полностью в виде белого осадка, который можно выделить фильтрованием.
Препарат почти не растворяется как в воде, так и в спирте и не имеет вкуса и запаха. При действии препарата увлажненная синяя лакмусовая бумажка краснеет, так как в лимонной кислоте остались еще свободные кислотные группы. В пробирку поместим пробу порошка — на кончике скальпеля, — добавим немного раствора едкого натра и слегка нагреем. По резкому запаху метаналя мы заметим, что препарат подвергается расщеплению. На этом и основано его применение. В мочевыводящих путях препарат отщепляет метаналь и в результате проявляет антисептические свойства. Кроме того, высвобождающаяся лимонная кислота очищает мочу. Разумеется, мы не станем принимать изготовленный нами препарат, так как из-за недостаточной чистоты использованных исходных веществ он вполне может содержать примеси (иногда даже ядовитые!).
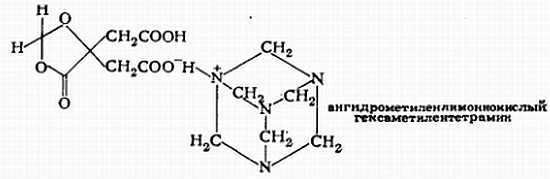
Вспомним теперь то, что было сказано о строении лекарственных веществ в самом начале, перед описанием первого опыта. Активной составной частью нашего препарата является метаналь (формальдегид) — вещество очень простого строения. Однако, вследствие неприятного запаха и вкуса его нельзя принимать в качестве лекарства. Гексаметилентетрамин (уротропин), хотя он не имеет запаха и имеет сладковато-горький вкус, тоже не годится в качестве антисептика для мочевыводящих путей, так как при действии разбавленных кислот он легко отщепляет метаналь. (Давайте, докажем это опытным путем!) Принятый в качестве лекарства гексаметилентетрамин расщепляется уже в желудке соляной кислотой желудочного сока, а возникающий при этом метаналь присоединяется к содержащимся в желудке белкам и в результате преждевременно теряет свою активность. Поэтому гексаметилентетрамин путем соединения с ангидрометиленлимонной кислотой переводят в нерастворимую форму, которая разлагается лишь непосредственно в мочевых путях. Сам гексаметилентетрамин, а также его другие, растворимые в воде производные, часто употребляются как наружное средство для дезинфекции, а также против повышенной потливости.
ВОКРУГ САЛИЦИЛОВОЙ КИСЛОТЫ
Каждый из нас простужался. Если температура поднималась, врач нередко прописывал таблетки ацетилсалициловой кислоты (аспирина). Вскоре после приема таких таблеток, имеющих сладковатый, вяжущий вкус, температура тела заметно снижалась и резко усиливалось выделение пота.
Это один из важнейших лекарственных препаратов, который отлично помогал еще нашим бабушкам и дедушкам. Недаром его аптечное название — аспирин — всем известно. Ацетилсалициловая кислота, принадлежащая к числу старейших синтетических лекарственных веществ, по объему производства до сих пор занимает первое место среди лекарств. По своей химической природе она является производным салициловой кислоты, с которой стоит познакомиться ближе.
Салициловой кислоте соответствует следующая формула:
В соседних положениях бензольного кольца у нее находятся группа ОН, как у фенола, и группа СООН — как у бензойной кислоты. Салициловая кислота широко распространена в природе. Ее производные — большей частью такие, в которых она связана с остатком глюкозы, — содержатся, например, в листьях ивы, от латинского названия которой — Salix — происходит название салициловой кислоты, а также в эфирных маслах из различных растений, обитающих за пределами ГДР.
Первоначально салициловую кислоту получали из вытяжек листьев ивы или из масла американского барвинка, но еще в 1873 г. немецкий химик Кольбе открыл простой способ ее синтеза, который до сих пор в крупных масштабах используется в промышленности. По этому методу салициловую кислоту получают из фенола, натриевую соль которого обрабатывают диоксидом углерода. Сначала количество салициловой кислоты, полученной таким образом, измерялось килограммами. Однако вскоре, когда ее стали применять для консервирования, а также в медицине (вместе с некоторыми ее производными) в качестве жаропонижающих и противоревматических средств, спрос резко увеличился. Уже в 1878 г. произведено 25 000 кг салициловой кислоты и во всем мире тогда едва ли существовала хотя бы одна крупная аптека, в которой не было бы выпущенной в Германии салициловой кислоты. Таким образом, салициловая кислота стала родоначальницей первой группы синтетических лекарственных препаратов и с ее производства началось вообще развитие фармацевтической промышленности.
Опыты с салициловой кислотой
Для следующих опытов используем купленную в аптеке салициловую кислоту — кристаллический порошок, трудно растворимый в холодной воде и легко растворяющийся в горячей, а также в спирте и ацетоне. При осторожном нагревании в пробирке салициловая кислота возгоняется, а при сильном нагревании расщепляется с образованием фенола и диоксида углерода.
Салициловая кислота и многие ее производные дают с солями трехвалентного железа интенсивное фиолетовое окрашивание. Растворим немного салициловой кислоты в воде и добавим несколько капель сильно разбавленного раствора хлорида железа (III). Окраска устойчива при хранении или нагревании раствора. Однако такую окраску с хлоридом железа могут давать и другие органические соединения. Например, растворим в воде кристаллик фенола (С фенолом нужно работать в резиновых перчатках, так как он вызывает на коже ожоги. — Прим. перев.) (Осторожно! Яд!) и смешаем этот раствор с хлоридом железа. При этом тоже появится фиолетовое окрашивание. В двух других пробирочных опытах растворим фенол и салициловую кислоту не в воде, а в спирте. Теперь окраску с хлоридом железа даст только салициловая кислота.
Возьмем навеску 0,5 г салициловой кислоты, внесем ее в химический стакан и при слабом нагревании растворим в 250 мл воды. Отберем пипеткой 1 мл раствора и разбавим его в пробирке 9 мл воды. Затем из этой пробирки снова отберем 1 мл и опять в другой пробирке разбавим раствор в 10 раз. В третьей и четвертой пробирке снова разбавим раствор таким же образом. Теперь в каждую из 4 пробирок добавим несколько капель раствора хлорида железа и посмотрим, до какого разбавления можно еще обнаружить фиолетовую окраску.
Салициловая кислота вступает и в некоторые другие реакции, которые могут служить для ее обнаружения и в то же время дают нам наглядное представление о ее химических свойствах.
Нальем в пробирку 3 мл концентрированной серной кислоты и осторожно добавим 3 капли формалина, то есть раствора метаналя. Полученный раствор называется реактивом Коберта. Если ничтожно малое количество салициловой кислоты поместить на часовое стекло, добавить 2 капли серной кислоты и через несколько минут смешать с одной каплей реактива, то вскоре появится розовое окрашивание (иногда для этого необходимо слабое нагревание).
К малому количеству приготовленного ранее раствора салициловой кислоты добавим несколько капель раствора сульфата меди и нагреем. Мы увидим яркое изумрудно-зеленое окрашивание.