Кроме того, отредактированные гены будут переданы следующему поколению. Генетически модифицированная девочка, которая вырастет и станет бабушкой, может передать измененный ген внукам, а те в свою очередь – своим внукам. Здесь скрыты одновременно возможность и риск для будущего всего человечества. Именно поэтому, когда Хэ Цзянькуй сообщил о рождении девочек, шумела публика и щелкали фотокамеры.
* * *
Хэ Цзянькуй связался с организацией, занимавшейся поддержкой ВИЧ-инфицированных в Китае, и попросил найти пару, которая хочет завести детей, при этом отец должен быть ВИЧ-инфицирован, а мать нет. Цель эксперимента состояла в том, чтобы обеспечить ребенку защиту от случайного заражения от отца на протяжении жизни и избавить от дискриминации и стигматизации, которым часто подвергаются ВИЧ-инфицированные в Китае. Именно поэтому ученый намеренно искал отца, который сам пережил опыт дискриминации из-за своего диагноза. Для того чтобы ребенок не получил болезнь от отца, обычно сперму очищают, убирают вирусы. Так поступил и Хэ Цзянькуй.
Первоначально на эксперимент решились три пары, но позднее одна из них отказалась от участия[23]. Родители могли выбирать между модифицированным эмбрионом, в котором Хэ Цзянькуй попытается отредактировать ген CCR5, и обычным эмбрионом. Обе пары предпочли модификацию. На момент доклада Хэ Цзянькуя еще одна женщина была беременна генетически модифицированным ребенком, который, предположительно, родился в 2019 г. К вопросу, почему судьба этого ребенка остается неизвестной, я еще вернусь.
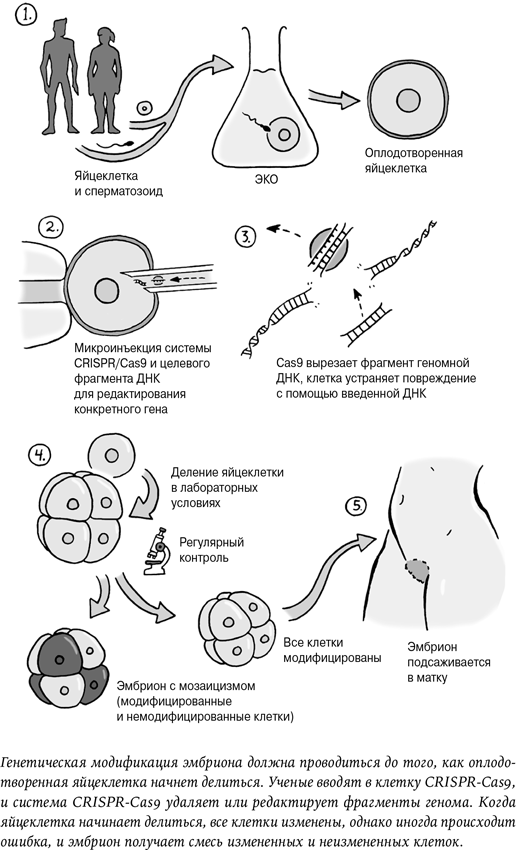
Когда Хэ Цзянькуй продемонстрировал результаты своей работы, стало очевидно, что строго тот вариант CCR5, который, как считается, защищает от ВИЧ, ему получить не удалось. Вместо этого он создал новые мутации, которые могли иметь или не иметь такой же эффект. У одной из девочек все прошло в целом так, как планировалось, и все ее клетки получили новый вариант гена.
У второй девочки произошло то, с чем часто сталкиваются ученые при генетической модификации животных: изменились не все клетки. Возможно, это случилось потому, что на момент модификации клетки уже начали делиться. Это означает, что тело девочки сейчас представляет собой мозаику из модифицированных и немодифицированных клеток. Неизвестно, защитит ли это ее от ВИЧ и даст ли какие-либо иные эффекты[24]. Хэ Цзянькуя критиковали за то, что он не прервал работу, когда понял, что мутация отличается от изученного варианта и не все клетки изменились.
Кроме того, есть опасения, что CRISPR-ножницы одновременно сработали также в других местах и внесли в организмы девочек и другие изменения. Обнаружить мелкие изменения генома чрезвычайно сложно. Хэ Цзянькуй утверждает, что искал подобные нецеленаправленные изменения, но ничего не нашел, хотя полной уверенности здесь быть не может.
На данный момент нет никаких международных законов, которые запрещали бы ученым или государствам осуществлять генетическую модификацию плода. Конвенция о защите прав и достоинства человека в связи с применением достижений биологии и медицины, принятая в Овьедо (Испания) в 1997 г. и подписанная более чем 30 странами[25], ограничивает искусственную модификацию генома человека. При этом некоторые страны, в их числе Великобритания, отказались от подписания конвенции по причине слишком жестких ограничений – в то время как Германия не подписала документ, посчитав, что он дает слишком большую свободу действий.
Таким образом, существуют различные точки зрения на генетическую модификацию, и отношение к вопросу определяется законодательством каждой конкретной страны. Тем не менее в 2015 г. группа ведущих генетиков мира предложила своего рода джентльменское соглашение. Ученые договорились проводить генетическую модификацию эмбрионов только в исследовательских целях, для лучшего понимания особенностей заболеваний и эмбрионального развития. Иными словами, генетическая модификация возможна только для тех эмбрионов, которые не станут детьми. Исследователи пришли к выводу, что все попытки генетически модифицировать детей безответственны, поскольку еще не решены все проблемы с обеспечением безопасности, не получено широкое социальное одобрение подобных экспериментов и процесс не может развиваться открыто с участием всего научного сообщества. Поставленные цели были несколько идеализированными, но здравыми. На данном этапе никакого вмешательства[26]!
Справедливости ради следует отметить, что основные направления деятельности определялись на встрече ученых в конце 2015-го в некоторой спешке. Генетика была еще очень молодой. Конечно, все с самого начала поняли, что появился новый научный инструментарий, который может применяться и для работы с человеческими эмбрионами, но большинство экспертов полагали, что на практике для этого потребуется время. Причиной отчасти служило законодательство, а отчасти – что тоже немаловажно – тот факт, что наука развивается скачкообразно.
Однако на сей раз все произошло молниеносно. Незамедлительно после публикации первых материалов о действии генетических ножниц CRISPR в 2012 г. китайские ученые приступили к экспериментам с генетической модификацией человеческих эмбрионов. Первая научная статья, в которой говорилось о принципиальной возможности генетической модификации, появилась весной 2015 г.[27] В ней рассказывалось о попытках китайских ученых редактировать ген, вариант которого вызывает талассемию – наследственное заболевание крови, распространенное в Юго-Восточной Азии и Средиземноморском регионе. Результаты эксперимента впечатлили и вызвали обеспокоенность, вследствие чего в том же году и была проведена встреча, на которой определились основные направления деятельности. Число опубликованных после этого научных статей о модифицированных человеческих эмбрионах весьма невелико. Но спустя некоторое время ряд стран, в числе которых США, Великобритания и Швеция, в научных целях и для понимания проблематики начинают проводить опыты с редактированием эмбрионов методом CRISPR. Главные результаты приходят, впрочем, из Китая, где с помощью усовершенствованной технологии удается решить некоторые проблемы, но по-прежнему чисто научного характера: детей еще нет. Пока еще нет.
* * *
Пекинский Запретный город окружен хутунами. Это огромная территория, застроенная одноэтажными домами с маленькими дворами, сложной системой входов и узкими улочками. Некоторые части квартала появились еще в XIV веке, и, несмотря на многочисленные реконструкции и социальные перемены, жизнь в центральных хутунах по-прежнему бьет ключом. Люди сидят за столами, играя в игры, или курят, стоя у калиток и краем глаза наблюдая за бегающими детьми. Здесь на узких улочках города, которому 3000 лет, кажется, что время не движется. Я приехала сюда узнать о последних достижениях китайских ученых-генетиков.
Если пойти через пестрые хутуны на восток от Запретного города, то через полчаса окажешься у нового торгового центра, расположенного на границе со старыми кварталами. Он похож на только что приземлившийся космический корабль, созданный богатыми инопланетянами с высоко развитым чувством прекрасного. Огромные овальной формы ульи из белого бетона и черного стекла соединены плавными переходами с подсвеченными фонтанами и скульптурами. Внутри множество магазинов, семьи делают покупки. Это новый Китай, страна, которая внушает европейцу чувство, будто он нежданно-негаданно переместился в будущее. В местном Starbucks меня ждет Тан Личунь, один из первых ученых, кому удалось модифицировать человеческий эмбрион в лаборатории.