Разнообразие вирусов огромно, порядка шести миллионов, и они далеко не все похожи на нашего панмедийного врага. Одни – как он, другие имеют форму спирали, яйца или, как на рисунке ниже, могут напоминать букву фу из японской азбуки катакана[11]. Их размеры тоже варьируются: от 20 до 300 нм в диаметре. Интересно, что вирусы могут поражать не только людей и животных, но и бактерии – таких называют бактериофагами, их обнаружил в 1917 году французский микробиолог Феликс д’Эрелль (1873–1949), не писавший никаких диссертаций и едва ли вообще имевший высшее образование[12].
Известные формы вирусов. Рис. Анны Полищук
Как часто случается, открыл он их в результате других научных изысканий. После Первой мировой войны ученый с внешностью Дон Кихота занимался патогенными бактериями дизентерии, натолкнувшись на ранее неизвестного агента (инфекцию), который вызывал их смерть. Д’Эрелль начал специально заражать бактерии этим агентом и обнаружил, что он успешно увеличивает свою популяцию за счет их уничтожения. Затем д’Эреллю приходит в голову сногсшибательная мысль – как тут не согласиться с Аристотелем, что творец доводит природу до совершенства – лечить бактериальные болезни с помощью бактериофагов! Инертный ученый мир отнесся к этому скептически, однако в те времена еще не существовало антибиотиков, и предложить что-то более эффективное никто не мог. Д’Эрелль, поверив с свой метод – благо над ним не стояло государство, как сегодня над Раулем – начал его применение и получил положительные результаты, которые он изложит в книге «Бактериофаг» (1922). Самым поразительным остается описание процесса выделения, «самоидентификации», фагов-агентов из бактерий и их внеклеточного существования.
Но бактериальная драма на этом не заканчивается. Многие годы спустя биолог Сальвадор Лурия, сбежавший из муссолиниевской Италии в США, покажет, что бактерии научаются сопротивляться фагам и это умение они передают генетически. В Америке Лурия, вместе с Максом Дельбрюком и Альфредом Херши, организует неформальное научное сообщество под названием «Phage Group», куда войдет еще ряд крупных ученых, внесших огромный вклад в создание науки микробиологии. Но все это произойдет потом. А в 1934 году Сталин приглашает д’Эрелля в СССР для продолжения работы над бактериофаготерапией, чем он и займется в Тифлисе в компании со своим грузинским коллегой Гиоргием Элиавой[13], прекрасно знавшим труды француза в этой области. Бактериологи познакомились сразу после войны в Институте Пастера в Париже, куда Элиава начал ездить с научными целями, а д’Эрелль тогда в очередной раз прибыл из Мексики, где он добывал алкоголь из сока агавы. Поработав в Институте несколько лет, д’Эрелль покинет его из-за склок с администрацией. В 1921 году Элиава создает в Грузии бактериологический институт, где сам успешно занимается исследованиями фагов – до 1937-го, пока не будет расстрелян как враг народа.
В 1930-х Дельбрюк и Лурия разрабатывали количественную методологию по изучению лигических взаимодействий бактериофага и клетки, что помогло лучше понять механизм мутации. Херши со своими коллегами доказал, что генетическая информация бактериальных вирусов закодирована в их нуклеиновых кислотах, это в свою очередь дало возможность установить фундаментальную характеристику вирусов, а именно: они содержат либо РНК, либо ДНК. Далее ученые выяснили, что помимо лизиса, которые вызывают вирусы у зараженных бактерий, имеет место и так называемая вегетативная вирусная инфекция, когда фаги проникают в «хозяина» (в данном случае в бактерию) без лигических осложнений. Это явление стали рассматривать как пассивную инфекцию, и благодаря ему прояснился механизм встраивания вирусов в «хозяйскую» хромосому.
Фаги действуют как настоящие хищники: нападая на бактерию, они впрыскивают в нее свой генетический материал, запуская механизм редупликации. Но если от укуса тарантула, тоже впрыскивающего в свою жертву яд – в эпоху Ренессанса он считался причиной безумия, – пострадавшие вылечивались экстатическим танцем «тарантеллой», то у пораженной фагом бактерии такой возможности нет. В танце или без него бактерия начинает работать на производство фагов, чей геном мутирует, смешиваясь с геномом хозяина.
Захват клетки бактериофагом. Рис. Анны Полищук
Помимо РНК или ДНК, находящихся внутри агента, последний обладает еще и белковой оболочкой – капсидом (на рисунке ниже он изображен треугольником), который защищает вирус от угрозы и помогает при захвате клетки. Некоторые вирусы вдобавок покрыты липидной оболочкой, жировым слоем, который защищает их от угроз внешней среды.
Мутированный бактериофаг. Рис. Анны Полищук
Структура агента. Рис. Анны Полищук
Агенты могут содержать до двух цепочек ДНК или одну цепочку РНК, способную удваиваться или достраи вать на себе цепочку РНК, таким образом вирусы способны размножаться в различных органеллах зараженной клетки. Органеллы – это микроструктуры, расположенные в цитоплазме клетки и выполняющие различные функции по ее жизнеобеспечению. Сами органеллы делятся на мембранные и немембранные. К первым относятся, например, удивительный «аппарат Гольджи» (Golgi apparatus), как его принято называть в биологии, открытый итальянским гистологом Камилло Гольджи. Он напоминает поезд из мембранных цистерн, работающий на станции, его задача – сортировать проходящие через станцию белки. Если чуть более подробно, то аппарат, или станция Гольджи ответственна за три вида белковой массы: плазматическую мембрану, секреты – жидкости, выделяемые клетками, в которой содержатся биологически активные вещества, и энзимы – молекулы белка, которые служат для ускорения химических процессов в клеточных организмах.
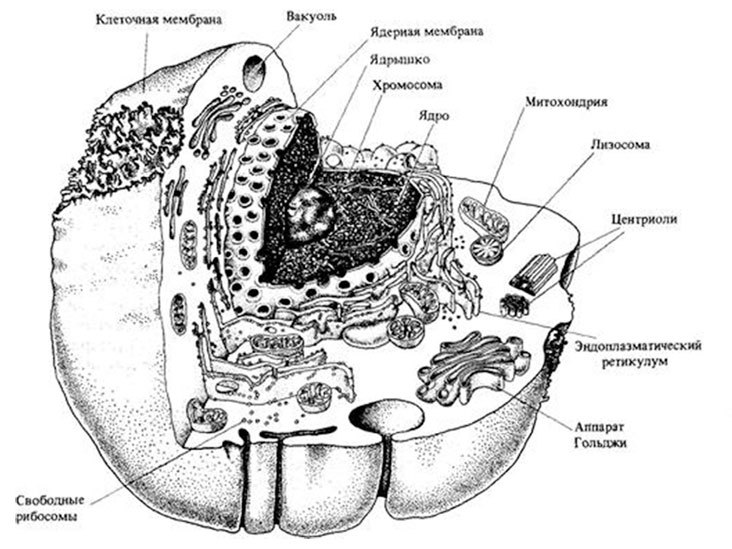
Строение клетки
К немембранным органеллам относится рибосома, играющая фундаментальную роль в синтезе белковых молекул из аминокислот по программе, которая в свою очередь определена генетическим кодом – матричной РНК. Эта мРНК в свою очередь состоит из последовательности кодонов – единиц генетического кода, или триплетов, содержащих тройку нуклеотидов. В эукариотических клетках, о них шла речь выше, рибосомы могут располагаться как на мембранах ретикулума (эндоплазматической сетки), так и быть сателитами цитоплазмы, то есть находиться в незакрепленном на ней виде.
Репликация вирусов с позитивным геномом, к которым относится и коронавирус (на сегодняшний день выявлены два его штамма, типа L и S), происходит благодаря способности геномной РНК выступать в качестве мРНК после заражения. Авторы «Вирусологии» отмечают, что «это имеет двоякие последствия. Во-первых, ферменты, ответственные за репликацию генома, синтезируются после заражения, и нет необходимости в их внесении в зараженную клетку вместе с вирионом ‹…› Во-вторых, так как все позитивные геномы относятся к монолитным и все их гены сосредоточены в одной хромосоме, первичный продукт трансляции обеих РНК (как геномной, так и мРНК) обязательно представляет собой единый белок»[14]. У вируса с негативным геномом прибавляется работа: его геномная РНК служит панелью одновременно для редупликации и транскрипции, то есть заражение должно быть внесено в клетку заранее. Работы, конечно, у «негативистов» больше, но при этом у них есть и преимущество: при промощи splicing’а (который МакКлинток исследовала на кукурузе) – процесс создания зрелого РНК, когда вырезаются интроны и сшиваются экзоны[15] – обеспечивает формирование ряда мРНК с одного и того же участка генома. В этом случае вирус берет под тотальный контроль клеточный белок.