Углеродный атом со своими четырьмя выступами может давать нескончаемый ряд молекул. Это объясняет, почему на Земле так широко распространены соединения углерода и почему они играют столь важную роль в живой материи. Рассмотрим некоторые соединения углерода. Простейшее из них — метан (рис. 33) с одним водородом на каждом выступе.
Рис. 33. Схематические изображения молекул углеводородов. Квадратики — атомы углерода, маленькие кружки— атомы водорода, прямые соединительные линии — связи типа «электронные близнецы».
Можно построить и молекулу из двух атомов углерода и шести атомов водорода. Здесь все связи типа «близнецы». Эта молекула называется этаном. Тот же принцип построения можно продолжить (см. рис. 33), и мы получим ряд молекул, называемых углеводородами: пропан с тремя атомами углерода, бутан с четырьмя и т. д. Эта структура, подобная цепи, может иметь любую длину. Короткие молекулы — это газы, более длинные — жидкости и очень длинные — твердые тела. Они служат горючим в виде газа, нефти или парафина, и мы увидим далее, почему они здесь хороши. Углеводородные цепи очень важны и для нашего питания, если они оканчиваются характерной группировкой атомов, называемой карбоксильной группой (рис. 34).
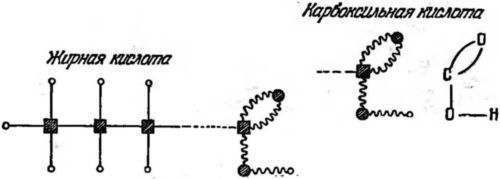
Рис. 34. Схематическое изображение молекул жирных кислот. Длинный углеводород с карбоксильной группой на правом конце. Карбоксильная группа, СООН, состоит из одного атома углерода, двух атомов кислорода и одного атома водорода, соединенных связями типа «дыра и затычка». Квадратики — атомы углерода, большие кружки — атомы кислорода, маленькие кружки — атомы водорода. Прямые линии — связи типа «электронные близнецы», волнистые — типа «дыра и затычка».
Эти цепи называются жирными кислотами, входящими в состав животного жира.
Другие характерные углеродные структуры — это молекулы спиртов, показанные на рис. 35.
Рис. 35. Молекула спирта C2H5OH. Квадратики — атомы углерода, большие кружки — атомы кислорода, маленькие кружки — атомы водорода; прямые линии — связи типа «электронные близнецы», волнистые — типа «дыра и затычка».
Здесь связи с кислородом образованы по типу «дыры и затычки».
Еще одна важная группа молекул с длинными цепями — это углеводы. Их цепи подобны углеводородным, но к каждому звену цепи присоединен кислород. Он, как всегда, соединяется по типу «дыры и затычки». Простейший углевод — глюкоза, один из видов сахара (рис. 36).
Рис. 36. Сахар. Молекула глюкозы С6Н12О6.
Целлюлоза — также углевод, но с очень длинной цепью. Она встречается в больших количествах в древесине и в других растительных структурах.
Теперь мы переходим к рассмотрению наиболее важной группы молекул — аминокислот, служащих кирпичиками, из которых построена почти вся живая материя. На рис. 37 показан общий принцип построения таких структур.
Рис. 37. Аминокислоты. Аминокислоты имеют с одного конца карбоксильную группу, а с другого — аминогруппу NH2. Символом R обозначены химические соединения различного типа.
В скелет этих молекул опять-таки входит углерод с его четырьмя электронными выступами. Наиболее характерны, однако, две их конечные группы. На одном конце молекулы (на рис. 37 справа) находится карбоксильная группа, на другом — аминогруппа NH2. Между двумя конечными группами находится множество других; для каждой аминокислоты характерна ее средняя часть. На рис. 37 показаны две простейшие аминокислоты: глицин и аланин — и общее строение более сложных аминокислот. Две концевые группы аминокислот обладают весьма характерным свойством. Они легко могут соединяться. Аминогруппа и карбоксильная группа связываются друг с другом (так называемая «пептидная связь»), так что аминокислоты легко образуют длинные цепи: одна аминокислота как бы зацепляется за другую. Такие цепи называются белками; как мы узнаем из гл. VIII, они играют важную роль в жизни живых организмов.
Химическая энергия, химическое горение
До сих пор мы давали общее описание некоторых наиболее распространенных молекул. Условия нашей среды на Земле таковы, что молекулы непрерывно разлагаются и снова образуются. Если бы температура Земли была значительно выше, например, если бы она достигала температуры поверхности Солнца, то молекулы никогда не образовывались бы из-за слишком сильного теплового возбуждения: атомы не могли бы оставаться друг возле друга. Если бы ее температура была гораздо ниже, молекулы соединились бы, образуя твердые тела и кристаллы, и никакие изменения не происходили бы. Температура на Земле такова, что имеется иногда достаточно энергии для разрушения некоторых молекул, однако количество этой энергии не слишком велико, и поэтому большинство соединений может существовать в течение некоторого времени. Создание и разрушение молекул характеризует окружающую нас среду, сообщая ей постоянные изменения, которые мы видим, и создавая тем самым возможность жизни.
Одно из важнейших следствий образования молекул состоит в высвобождении энергии. Этот процесс особенно ясно виден при сжигании угля или других веществ. Горение любого типа связано с образованием новых молекул, в результате чего выделяется тепловая энергия. Мы должны теперь выяснить более точно, как и почему освобождается энергия при соединении атомов в молекулы. Химическая связь представляет энергию в таком смысле: для разрыва связи требуется некоторое количество энергии, следовательно, то же ее количество высвобождается при образовании связи. В качестве простейшего примера связи, отличной от химической, рассмотрим магнит, удерживающий кусок железа силой магнитного притяжения (рис. 38).
Рис. 38. Когда железка ударяется о магнит, энергия магнитного притяжения превращается в тепло и звук.
Чтобы удалить железо от магнита, требуется некоторая энергия. Когда железо возвращается к магниту, то же количество энергии выигрывается. Это количество энергии создается притяжением к магниту. При удалении железа от магнита энергию поставляют наши мышцы. Где появляется энергия, производимая при возвращении железа к магниту? Часть ее выделяется в виде звука, когда железо ударяется о магнит, часть — в виде тепла, так как при ударе железа о магнит оно нагревается. Эту энергию можно использовать и для выполнения механической работы: если мы прикрепим к железу веревку, перекинутую через блок, а на другой ее конец подвесим грузик, то увидим, что притяжение к магниту будет совершать работу (рис. 39).
Рис. 39. При таком расположении магнита и пластинки энергия притяжения используется для подъема груза.
Аналогичный обмен энергией происходит и в случае химической связи. Нужно затратить энергию, чтобы разделить молекулу на атомы, и энергия выделяется, когда атомы образуют молекулу. Полученная энергия принимает различные формы. Например, она может проявиться в виде колебаний. Когда атомы соединяются, получившаяся молекула начинает колебаться в результате сильного столкновения атомов. Может получиться и энергия поступательного движения: когда атомы сталкиваются и сливаются, их энергия передается соседним молекулам, скорость которых увеличивается. Вообще, когда бы атомы ни образовали молекулу, энергия освобождается и обычно проявляется в форме движения, что эквивалентно теплу.