1 — липофусцин; 2 — цитоплазма; 3 — ядро
Источник образования старческого пигмента пока не выявлен. Ряд исследователей высказывается в пользу лизосом, так как с процессом его образования связаны некоторые гидролазы [2, 12, 14, 44, 50]. Другие [13, 18, 24] считают, что источником липофусцина являются митохондрии. Они предполагают, что он образуется при перекисном окислении полиненасыщенных липидов в этих клеточных органеллах [44, 48]. Липофусцин представляет собой весьма сложное, имеющее сопряженные связи и поперечные сшивки соединение, которое накапливается, как правило, в цитоплазме неделящихся клеток — нейронов, клеток сердечной и скелетной мышц. У крыс его накопление в аэробных тканях интенсивнее, чем в анаэробных [39]. При освещении ультрафиолетовым светом наблюдается его флуоресценция с масимумом между 430 и 490 нм. Липофусцин окрашивается Суданом черным, нильским голубым и ШИК-положителен.
Некоторые ферменты, например кислые и щелочные фосфатазы и глюкуронидаза, образуют с ним ассоциаты. В состав липофусцина входят металлы — цинк и кальций, углеводы, белки и в больших количествах нейтральные и кислые полимерные липиды. Пигмент хорошо растворяется в кислотах. В некоторых тканях его концентрация линейно увеличивается с возрастом, возможно, потому, что клетки утрачивают способность его удалять. Например, его количество линейно возрастает в семенниках мышей [29]. В основном его накопление происходит в клетках Сертоли и интерстициальных клетках, но не в сперматогонии. Высокая способность сперматогония препятствовать накоплению пигмента может быть интересной темой исследования. Накопление липофусцина в гиппокампе и зрительной коре старых крыс протекает быстрее, чем у молодых животных, причем с возрастом одновременно уменьшается количество клеток [10]. Все это должно воздействовать на функции мозга.
Появление в цитоплазме больших количеств неактивного пигмента должно, очевидно, инактивировать клетку. У старых мух Drosophila до 50 % объема клеток занято липофусцином [1]. Однако, если сравнить его содержание у диких дрозофил и у редкого мутанта, имеющего более короткую продолжительность жизни, никакой корреляции не наблюдается. В том и в другом случае пигмент накапливается с одинаковой скоростью. Таким образом, перекисное окисление липидов и накопление старческого пигмента не имеют явного отношения к уменьшению продолжительности жизни. Раннее накопление пигмента наблюдается у людей, страдающих наследственной болезнью- нейронным цероидлипофусцинозом (синдром Баттена — Фогта), а также у собак с ювенильной амавротической идиотией [55]. Значительное отложение пигмента наблюдается у людей, больных хореей Гентингтона и старческим слабоумием.
Липофусцин, очевидно, является побочным продуктом метаболизма и сам не метаболизируется, однако такие лекарственные препараты, как центрофеноксин (β-хлорфеноксиацетиловый эфир диметиламиноэтанола) и диметиламиноэтанол, уменьшают его отложение в нейронах морских свинок и мышей. Введение центрофеноксина в течение 12 нед или более приводит к заметному уменьшению количества старческого пигмента в мозгу морских свинок, крыс и мышей [25, 26, 28, 32, 37, 43]. В нейронах коры головного мозга мышей в возрасте одного месяца старческого пигмента не обнаружено. Он появляется в возрасте 2–3 мес, и затем его количество постепенно возрастает. В гиппокампе обнаружено больше старческого пигмента, чем в коре головного мозга. Если мышам-самкам ежедневно вводить внутрибрюшинно центрофеноксин (80 мг·кг-1 веса) начиная с месячного возраста в течение 2-11 мес, накопление липофусцина в нейронах коры головного мозга и гиппокампа заметно уменьшается (рис. 6.2 и 6.3) [33, 34]. После введения препарата в течение 3 мес улучшаются обучаемость и память 11-12-месячных мышей. Было сделано заключение, что центрофеноксин вызывает разрушение старческого пигмента и тем самым препятствует его накоплению [25, 43]. Хотя несколько исследователей показали, что этот препарат уменьшает накопление липофусцина, остается неясным, происходит ли это из-за предотвращения его отложения или из-за удаления уже отложившегося пигмента. Кроме того, необходимо учесть и оценить побочные эффекты от употребления высоких доз препарата.
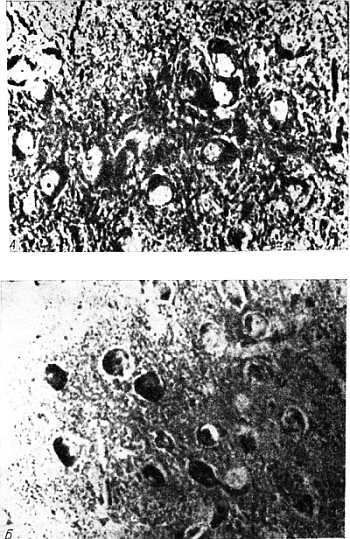
Рис. 6.2. Окрашивание липофусцина нильским голубым в нейронах коры головного мозга мышей в возрасте 6 мес; ×600 [33, 34].
А. Контроль. Б. После введения центрофеноксина в течение 5 мес
Рис. 6.3. Окрашивание липофусцина нильским голубым в нейронах коры головного мозга мышей в возрасте 12 мес; ×600 [33, 34].
А. Контроль. Б. После введения центрофеноксина в течение 11 мес
Старческий пигмент начинает накапливаться по мере старения в цитоплазме Neurospora crassa. При введении нордигидрогваяретовой кислоты (НДГ), обладающей свойствами антиоксиданта, не только уменьшается его накопление, но и увеличивается продолжительность жизни [30]. НДГ и глутатион оказывают такое же действие на Podospora anserina [31].
Причины накопления старческого пигмента еще предстоит выяснить. Если это происходит из-за нарушений метаболизма, необходимо установить, какие факторы ответственны за эти нарушения. Очевидно, однако, что накопление липофусцина является лишь вторичной причиной старения.
Литература
1. Biscardi H. M., Webster G. C. Expl. Gerontol., 12, 201–205 (1977)
2. Bjorkerud S. Adv. Gerontol. Res., 1, 257–288 (1964).
3. Bjorksten J. J. Am. Geriat. Soc., 10, 125–139 (1962).
4. Bjorksten J. Theoretical Aspects of Aging (M. Rockstein, Ed.), 43–59, Academic Press, New York and London (1974).
5. Bjorksten J. In: Protein crosslinking: nutritional and medical consequences (M. Friedman, Ed.), 579–602 (1977).
6. Bourne G. H. Neurobiological Aspects of Maturation and Aging. In: Process in Brain Research (D. H. Ford, Ed.), 187–202, Elsevier, New York (1973).
7. Brizzee K. R. In: Neurobiology of Aging (J. M. Ordy and K. R. Brizzee, Eds.), 401–424, Plenum Press, New York (1975).
8. Brizzee K. R., Cancllla P. A., Sherwood N., Timiras P. S. J. Gerontol., 24, 197–135 (1969)
9. Brizzee K. R., Harkin J. C., Ordy J. M., Kaack B. Aging, 1, 39–78 (1975). 10. Brizzee K. R., Ordy J. M. Mech. Age. Dev., 9, 143–162 (1979).
11. Brizzee K. R., Ordy J. M., Kaack B. J. Gerontol., 29, 366–381 (1974).
12. Brodu H., Vijayashankar N. In: The Handbook of the Biology of Aging (C E Finch and L. Hayflick, Eds.), 248–254, Reinhold, New York (1977).
13. Colocolough H. L., Hack M. M., Helmy F. M., Vaughan G. E., Veath D. C. Acta Histochem., 43, 89-109 (1972).
14. DeDuve C. Symp. Soc. exp. Biol., 10, 50–67 (1957).
15. Epstein J., Gershort D. Mech. Age. Dev., 1, 257–264 (1972).
16. Essner E., Novikoff A. J. Ultra Res., 3, 374–391 (1960).
17. Friede R. L. Topographic Brain Chemistry, Academic Press, New York and London (1966).
18. Glees P., Hasan M., Spoerri P. E. J. Physiol., 239, 87 (1974).
19. Gordon P. In: Theoretical Aspects of Aging (M. Rockstein, Ed.), 61–81, Academic Press, New York and London (1974).
20. Harman D. J. Gerontol., 1, 298–300 (1956).