Щёлочи
Щёлочи,
растворимые в воде основания. Водные растворы Щ. характеризуются высокой концентрацией гидроксильных ионов OH¾
. К Щ. относятся гидроокиси щелочных металлов
, щёлочноземельных металлов
и аммония
.
Большинство Щ. — твёрдые белые весьма гигроскопичные вещества. Растворение их в воде сопровождается выделением большого количества теплоты. Растворы Щ. изменяют цвет кислотно-щелочных индикаторов химических
.
Наиболее сильными, т. н. едкими, Щ. являются гидроокиси щелочных металлов (например, NaOH, KOH), более слабыми Щ. — гидроокиси щёлочноземельных металлов [например, Ca (OH)2
, Ba (OH)2
] и аммония. К Щ. иногда относят соли сильных оснований и слабых кислот (см. Кислоты и основания
), водные растворы которых имеют щелочную реакцию, например гидросульфиды NaSH и KSH, карбонаты Na2
CO3
и K2
CO3
, гидрокарбонат NaHCO3
, буру Na2
B4
O7
и др. Щ. широко применяются в лабораторной практике и промышленности (см. Натрия гидроокись
, Калия гидроокись
, Кальция гидроокись
, Аммония гидроокись
).
Щёлочноземельные металлы
Щёлочноземе'льные мета'ллы,
химические элементы главной подгруппы II группы периодической системы Д. И. Менделеева, входящие в семейство кальция, — Ca, Sr, Ba, Ra (иногда к Щ. м. относят также Be и Mg). Происхождение название связано с тем, что окиси Щ. м. (по терминологии алхимиков — «земли») сообщают воде щелочную реакцию. Внешняя электронная оболочка атомов Щ. м. содержит 2 s
-электрона, ей предшествует оболочка из 2 s
- и 6 р
-электронов. Щ. м. проявляют в соединениях степень окисления +2. Химически Щ. м. активны, активность их возрастает от Ca к Ra. См. также Кальций
, Стронций
, Барий
, Радий
.
Щелочной аккумулятор
Щелочно'й аккумуля'тор,
электрический аккумулятор
, в котором активной массой отрицательного электрода служит пластина из пористого железа или кадмия, положительного электрода — никелевый каркас, заполненный окисью никеля (III), электролитом — 20-процентный раствор едкого кали. Преобразование электрической энергии в химическую (зарядка) и обратно (разрядка) происходит в результате такой реакции, как, например:
.
Эдс Щ. а. равна 1,3 в.
Удельная мощность Щ. а. меньше, чем у свинцового аккумулятора
, однако он хорошо переносит перегрузки, нечувствителен к избыточному заряду, а также к сильному разряду. Щ. а. отдаётся предпочтение при неблагоприятных режимах работы (например, в электрокарах, при запуске больших дизельных двигателей и т.д.).
Щелочной элемент
Щелочно'й элеме'нт,
см. в ст. Лекланше элемент
.
Щелочные горные породы
Щелочны'е го'рные поро'ды,
магматические горные породы, относительно богатые щелочными металлами — натрием и калием. Для минерального состава Щ. г. п. характерны нефелин и др. фельдшпатиды
(содалит, канкринит
, лейцит
), а также щелочные пироксены и амфиболы (эгирин
, арфведсонит и др.). По содержанию кремнезёма Щ. г. п. подразделяют на 3 гл. группы: ультраосновную — ийолиты, мельтейгиты, уртиты
(40—45% SiO2
), габброидную — тералиты, эссекситы (45—50%), и сиенитовую — щелочные и нефелиновые сиениты
, (св. 50% SiO2
). В земной коре представлены преимущественно небольшими (до 50—100 км
2
)
интрузивными телами нефелиновых и щелочных сиенитов или их эффузивными разностями (нефелиниты, фонолиты, лейцититы, тефриты) в составе вулканических щёлочно-базальтовых ассоциаций на континентах и океанических островах. Ийолиты и мельтейгиты типичны для комплексных щёлочно-ультраосновных массивов, где преобладают пироксениты и оливиниты; к этим массивам приурочены крупные месторождения карбонатитов
.
Среди нефелиновых сиенитов выделяют миаскитовые
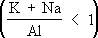
и более редкие агпаитовые разности
. Для агпаитовых пород характерны разнообразные минералы, богатые Zr, Ti, Nb, Sr. С Щ. г. п. связаны также апатитовые и нефелиновые руды в СССР (Хибины на Кольском полуострове) и за рубежом (Гренландия, Канада, Бразилия, Южная Африка).
Лит.:
Главнейшие провинции и формации щелочных пород, М., 1974; Щелочные породы. Сб. ст., пер. с англ., М., 1976.
Л. С. Бородин.
Щелочные металлы
Щелочны'е мета'ллы,
химические элементы гл. подгруппы I группы периодической системы элементов Д. И. Менделеева: Li, Na, К, Rb, Cs, Fr. Название получили от гидроокисей Щ. м., названных едкими щелочами
.
Атомы Щ. м. имеют на внешней оболочке по 1 s
-электрону, а на предшествующей —2 s-
и 6 р
-электронов (кроме Li). Степень окисления Щ. м. в соединениях всегда равна +1. Щ. м. химически очень активны — быстро окисляются кислородом воздуха, бурно реагируют с водой, образуя щёлочи MeOH (где Me — металл); активность возрастает от Li к Fr. См. также Литий
, Натрий
, Калий
, Рубидий
, Цезий
, Франций
.
Щель
Щель,
короткий и глубокий (1,5—2 м
)
ров, предназначенный для укрытия людей во время ядерного взрыва, артиллерийского обстрела, налёта авиации, атаки танков. Щ. устраиваются примкнутыми к траншеям или вне их; бывают открытыми сверху или с противоосколочным покрытием из дерева и земли.