Д. Е. Паэглите.
Озон
Озо'н (от греч. óz'ō '— пахну), аллотропное видоизменение кислорода; взрывчатый газ синего цвета с резким характерным запахом. В отличие от двухатомной молекулы «обычного» кислорода (O2), молекула озона трехатомна (О3). Впервые О. обнаружил в 1785 голландский физик М. ван Марум по характерному запаху (свежести) и окислительными свойствам, которые приобретает воздух после пропускания через него электрических искр. При нормальных условиях масса 1 л О. 2,1445 г. Плотность газообразного О. по кислороду 1,5, по воздуху 1,62. tпл — 192,7°С, tkип — 112°С. Ниже tkип О. — темно-синяя жидкость, плотность 1,71 г/см3 (при — 183°С), В газообразном состоянии О. диамагнитен, в жидком — слабопарамагнитен. Растворимость О. в воде 0,394 г/л (при 0°С), т.е. в 15 раз больше, чем у кислорода. О. образуется по обратимой реакции: 3O2 + 68 ккал (285 кдж) Û 2O3. Молекула О3 неустойчива и самопроизвольно превращается в O2 с выделением тепла. При небольших концентрациях (без посторонних примесей) О. разлагается медленно, при больших — со взрывом. Нагревание и контакт О. с ничтожными количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение. Наоборот, присутствие небольших количеств HNO3 стабилизирует О., а в сосудах из стекла, некоторых пластмасс или чистых металлов О. при —78°С практически не разлагается.
О. — один из наиболее сильных окислителей (гораздо сильнее обычного кислорода). Он окисляет все металлы (за исключением Au и платиновых), а также большинство др. элементов. При действии на некоторые неорганические и органические соединения образует озониды (см. Перекисные соединения). Присутствие О. в газовой смеси можно установить по реакции:
O3 + 2KI + H2O = I2 + O2 + 2KOH
«Обычный» кислород O2 в реакцию KI не вступает.
О. образуется в процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т.п. В промышленности его получают из воздуха или кислорода в озонаторах действием тихого электрического разряда при низких температурах. Сжижается O3 легче, чем O2, и потому их легко разделить.
Сильные окислительные свойства О. позволяют использовать его при получении многих органических веществ, для отбеливания бумаги, масел и т.д. О. убивает микроорганизмы, поэтому его применяют для очистки воды и воздуха (озонирование). Однако в воздухе допустимы лишь очень малые концентрация О., т.к. он чрезвычайно ядовит (даже более ядовит, чем угарный газ CO); предельно допустимая концентрация О. в воздухе 10–5%.
Озон в атмосфере
Озо'н в атмосфе'ре, определяет характер поглощения солнечной радиации в земной атмосфере. Содержится в ничтожном количестве: толщина слоя озона, приведённого к нормальным условиям давления и температуры (760 мм рт. ст. и О °С), в среднем для всей Земли составляет 2,5—3 мм, в экваториальных областях — около 2 мм, а в высоких широтах — до 4 мм. Основная масса О. в а. расположена в виде слоя — озоносферы — на высоте от 10 до 50 км с максимумом концентрации на высоте 20—25 км. В тропосфере содержание озона очень мало, изменчиво во времени и по высоте. Образование О. в а. и его распределение по высоте хорошо объясняется фотохимической теорией. Озон сильно поглощает радиацию в разных участках спектра, наиболее интенсивно — с длиной волн менее 2900
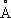
, поэтому весьма активная в биологическом отношении часть солнечной радиации не достигает земной поверхности. В результате поглощения радиации температура в слое озона сильно повышается. Исследование О. в а. производится анализом проб воздуха, взятых на разных высотах, а также оптическими приборами (спектрофотометрами и др.) на земной поверхности или поднимаемыми в атмосферу с помощью зондов и ракет.
Лит.: Прокофьева И. А., Атмосферный озон, М.—Л., 1951; Митра С. К., Верхняя атмосфера, пер. с англ., М., 1955, гл. 4.
Озониды
Озони'ды, один из видов перекисных соединений. Неорганические О., например КОз, характеризуются наличием молекулярного иона О–3 — (озонидный ион). В органических О. группировка О3 ковалентно связана с двумя радикалами (например,
Озониоз
Озонио'з, техасская корневая гниль, опаснейшая болезнь растений, вызываемая несовершенным почвенным грибом Ozonium omnivorum; объект внешнего карантина. Поражает и разрушает корневую систему более 2000 видов растений, листья которых желтеют, увядают и быстро засыхают. Встречается США и Мексике, где наносит большой ущерб хлопчатнику, люцерне, плодовым и декоративным культурам. Возбудитель О. распространяется с частицами почвы, посадочным (клубнями, корнеплодами, луковицами и т.д.) и упаковочным материалом. Меры борьбы — карантинные мероприятия (см. Карантин растений).
Озонирование
Озони'рование, применение озона для проведения реакций окисления, но главным образом для обработки воздуха и воды с целью их обеззараживания и устранения дурного запаха. О. воздуха проводят с помощью озонаторов в помещениях для переработки и хранения скоропортящихся продуктов (консервные, мясоперерабатывающие и др. заводы), иногда — в местах большого скопления людей. Для стерилизации воды её насыщают озонированным воздухом в специальных резервуарах — стерилизаторах; большое достоинство метода — отсутствие каких-либо остаточных веществ в воде.
Озургеты
Озурге'ты, прежнее (до 1934) название г. Махарадзе Грузинской ССР.
Озы
О'зы (швед., единственное число
s, буквально — хребет, гряда), длинные (до 40, иногда свыше 500
км), узкие (от нескольких
м до 2—3
км), высотой до нескольких десятков
м валы, сложенные горизонтальными или, чаще, косослоистыми песками, гравием, галькой, содержащими примесь валунов. Представляют собой отложение потоков талых вод, протекавших по промытым в теле ледника долинам и туннелям. Распространены в областях четвертичного (антропогенового) материкового оледенения (в Швеции, Финляндии, на С. Европейской части СССР).