В результате возросшего сжигания топлива (заводы, двигатели внутреннего сгорания) в атмосфере образуются окислы азота, которые попадают в почву и воду водоёмов с дождём в большом количестве и превращаются там с помощью нитрифицирующих бактерий в нитраты. Чрезмерное обогащение ими воды делает её непригодной для питья. Чтобы предупредить усиленное образование нитратов в воде, иногда применяют химические препараты, тормозящие Н. в почве.
Г. А. Заварзин.
Нитрифицирующие бактерии
Нитрифици'рующие бакте'рии, бактерии, превращающие аммиак и аммонийные соли в нитраты; аэробны, грамотрицательны, подвижны (имеют жгутики); обитают в почве и водоёмах. Выделены и описаны в 1890 рус. микробиологом С. Н. Виноградским (их открытие позволило ему создать учение о хемосинтезе). Превращение NH3 в нитраты — нитрификация — осуществляется в две стадии. Сначала нитритные бактерии (Nitrosomonas) окисляют NH3 до нитрита:
.
Во второй стадии нитратные бактерии (Nitrobacter) окисляют нитрит до нитрата:
.
Таким образом, между этими двумя группами Н. б. существуют метабиотические отношения: бактерии, окисляющие NH3, обеспечивают субстратом бактерий, окисляющих нитрит. Подобно др. хемоавтотрофам, Н. б. за счёт энергии окисления могут усваивать углерод CO2 атмосферы или карбонатов и использовать его для синтеза веществ, входящих в состав клетки (Н. б. не усваивают органические вещества, содержащиеся в почве, воде водоёмов или в искусственных питательных средах).
А. А. Имшенецкий.
Нитроаммофоска
Нитроаммофо'ска, сложное минеральное азотно-фосфорно-калийное удобрение. Содержит 50—54% N, P2O5 и K2O, выпускается в гранулах. Состоит из аммиачной селитры, аммофоса, диаммофоса, хлористого аммония, сульфата аммония и калийной селитры, получаемых в едином технологическом процессе при взаимодействии аммиака, азотной и фосфорной кислот, с добавлением хлористого калия и сульфата калия. Н. применяют как основное и припосевное удобрение под все культуры. См. Комплексные удобрения.
Нитроанилины
Нитроанили'ны, продукты замещения атомов водорода в ядре анилина C6H5NH2 нитрогруппами — NO2. Н. могут содержать от 1 до 5 нитрогрупп. Техническое значение имеют мононитроанилины (мета-, орто-, пара-изомеры) — кристалллические вещества жёлтого цвета [tпл (°С) 71,0 (о-Н.), 114,0 (м-Н.), 147,0 (n-Н.)], плохо растворимые в воде, в органических растворителях — хорошо. о-Н. и n-Н. — слабые основания, хуже растворимые в кислотах, чем мета-изомер (более сильное основание). При нагревании с водными растворами щелочей группа NH2 у о-Н. и n-Н. замещается на ОН-группу с образованием нитрофенолов. Н., содержащие более одной нитрогруппы, взрывчаты. о-Н. и n-Н. в промышленности получают нагреванием соответствующих нитрохлорбензолов с аммиаком, м-Н. — частичным восстановлением м-динитробензола сернистым натрием. Н. — кровяные яды; особенно опасно совместное воздействие Н. и спирта. Н. — промежуточные продукты в производстве азокрасителей и некоторых лекарственных веществ.
Лит.: Воронцов И. И., Полупродукты анилинокрасочной промышленности, М., 1955.
Нитробензол
Нитробензо'л, СбН5NO2, простейшее ароматическое нитросоединение; бледно-жёлтая маслянистая жидкость; tпл 5,7 °С, tкип 210,9 °С, плотность 1,987 г/см3 (25 °С); в воде растворяется плохо. Хорошо смешивается с органическими растворителями. При восстановлении в зависимости от условий Н. превращается в анилин или в гидразобензол (см. Гидразосоединения). Последний под действием кислот изомеризуется в бензидин. Нитрование, сульфирование и хлорирование Н. происходят главным образом в мета-положение к нитрогруппе, например:
Получают Н. нитрованием бензола нитрующей смесью. Н. ядовит; предельно допустимая концентрация в воздухе рабочих помещений 3 мг/м3, в воздухе населённых мест 0,008 мг/м3.
Основное назначение Н. — получение анилина; в небольших количествах Н. используют также в производстве промежуточных продуктов для красителей (метаниловой кислоты, бензидина и др.) и некоторых красителей (например, индулина).
Лит.: Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, Л., 1973.
Нитрование
Нитрова'ние, введение нитрогрупп — NO2 в молекулы органических соединений при действии различных нитрующих агентов. В зависимости от строения нитруемого соединения и условий реакции Н. может сопровождаться введением в молекулу др. функциональных групп, например — F (нитрофторирование), — ОН (окислительное нитрование) и др. Н. — один из наиболее изученных в теоретических и практических отношениях процессов.
Н. ароматических соединений осуществляется азотной кислотой, нитрующими смесями или неорганическими солями нитрония NO; вначале образуется комплекс (I) между катионом нитрония и бензолом:
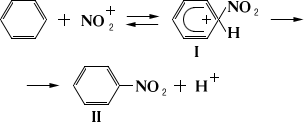
Затем отщепляется протон с образованием нитросоединения (II). Реакция осуществляется при комнатной или пониженной температуре. Для введения последующих нитрогрупп требуются более жёсткие условия. При прямом нитровании в ароматическое ядро можно ввести максимально три нитрогруппы. Наличие функциональных групп, обогащающих кольцо электронами, например амино-, сульфо-, оксигрупп, облегчает Н., причём в некоторых случаях эти группировки могут замещаться на нитрогруппы. Так, при Н. фенолсульфокислот сульфогруппа замещается нитрогруппой. Характер заместителей существенно влияет на ориентацию вступающей нитрогруппы (см. Ориентации правила). Н. ароматических соединений ускоряется в присутствии нитратов ртути, причём процесс может сопровождаться окислением (образуются как нитросоединения, так и нитрофенолы). О промышленном получении некоторых ароматических нитросоединений см., например, Нитроанилины, Нитробензол, Нитротолуолы, Нитронафталины.
Н. алифатических соединений ненасыщенного ряда, например, смесью уксусного ангидрида и азотной кислоты, начинается с атаки двойной связи катионом нитрония; образующийся катион (III) стабилизируется отщеплением протона с образованием нитроолефина (IV) или присоединением аниона (X), находящегося в реакционной смеси:
(X=CH3COO-, Cl-, OH- и др.).
Продукты реакции — обычно смеси нитросоединений. Н. ненасыщенных соединений двуокисью азота в инертных растворителях происходит по радикальному механизму, например:
Процесс также осложняется образованием смесей различных продуктов.
Н. углеводородов парафинового ряда разбавленной азотной кислотой впервые осуществил русский химик М. И. Коноваловв 1888 (см. Коновалова реакция). Н. алканов окислами азота или крепкой азотной кислотой происходит преимущественно по радикальному механизму: