Уровни энергии А. водорода и водородоподобных ионов. Энергия одноэлектронного А. (без учёта спина электрона) равна
целое число n = 1, 2, 3, ... определяет возможные дискретные значения энергии — уровни энергии; его называют главным квантовым числом. R — Ридберга постоянная, равная 13,6 эв. Уровни энергии А. водорода на схеме рис. 1, б построены для Z = 1 согласно формуле (4); они сгущаются (сходятся) к границе ионизации Е¥ = 0, соответствующей n = ¥ (уровни энергии с n > 5 на схеме не показаны). Для водородоподобных ионов изменяется (в Z2 раз) лишь масштаб энергий. Энергия ионизации водородоподобного А. (энергия связи электрона в таком А.) равна (в эв)
Еион = E¥ — E1 = RZ2 = 13,6Z2 (5)
что даёт для Н, Не+, Li2+, ... значения 13,6 эв, 54,4 эв, 122,4 эв, ...
Основная формула (4) соответствует выражению U (r) = —Ze2/r для потенциальной энергии электрона, притягиваемого ядром с зарядом +Ze [см. (2) и рис. 1, а для случая Z = 1]. Эта формула была впервые выведена Н. Бором в его теории А. (1913) путём рассмотрения движения электрона вокруг ядра по круговой орбите радиуса r. Уровням энергии (4) соответствуют орбиты радиуса
anZ = an2/Z (6)
где постоянная a0 = 0,529 10—8см = 0,529
— радиус первой круговой орбиты А. водорода, соответствующей его основному уровню (этим боровским радиусом часто пользуются в качестве удобной единицы для измерений длин в атомной физике). Радиус орбит пропорционален квадрату главного квантового числа
n2 и обратно пропорционален
Z; для водородоподобных ионов масштаб линейных размеров уменьшается в
Z раз по сравнению с А. водорода.
Характеристика квантовых состояний атома водорода. Согласно квантовой механике, состояние А. водорода полностью определяется дискретными значениями четырёх физических величин: энергии Е, орбитального момента Ml, (момента количества движения электрона относительно ядра); проекции Mlzорбитального момента на направление z (выбранное произвольно в пространстве); проекции Msz спинового момента (собственного момента количества движения электрона Ms). Возможные значения этих физических величин, в свою очередь, определяются соответствующими квантовыми числами:
1) Е — по закону (4) — главным квантовым числом n =1, 2, 3, ...;
2) Мl — по закону Ml2 = (h2/4p2)l(l + 1) [при l " 1, Ml2 = (h2/4p2)l2 — орбитальным (или азимутальным) квантовым числом l = 0,1, 2, ..., n—1;
3) Mlz — по закону Mlz = (h/2p)mlz — магнитным орбитальным квантовым числом ml = l, l—1, ..., —l;
4) Msz — по закону Msz = (h/2p)ms — магнитным спиновым квантовым числом ms = 1/2, —1/2.
Значения квантовых чисел n, l, ml, msи характеризуют состояние электрона в А. водорода. Энергия А. водорода зависит только от n, и уровню энергии с заданным n соответствует ряд состояний, отличающихся значениями l, mlи ms. Состояния с заданными значениями n и l принято обозначать как 1s, 2s, 2p, 3s, ..., где цифры указывают значение n, а буквы s, р, d, f (дальше по латинскому алфавиту) — соответственно значения l = 0, 1, 2, 3, ... При заданных n и l число различных состояний равно 2(2l + 1) — числу комбинаций значений ml и ms(первое принимает 2l + 1 значение, второе — 2 значения). Общее число различных состояний с заданными n и l при учёте, что l может принимать значения от 0 до n—1, получается равным
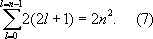
Т. о., каждому уровню энергии А. водорода соответствует 2, 8, 18, ..., 2n2(при n = 1, 2, 3, ...) различных стационарных квантовых состояний (рис. 2). Если уровню энергии соответствует лишь одно квантовое состояние, то его называют невырожденным, если два или более — вырожденным (см. Вырождение), а число таких состояний g называются степенью или кратностью вырождения (для невырожденных уровней энергии g = 1). Уровни энергии А. водорода являются вырожденными, а их степень вырождения gn = 2n2.
Для различных состояний А. водорода получается и различное распределение электронной плотности. Оно зависит от квантовых чисел n, l и /mi/. При этом электронная плотность для s-cocтояний (l = 0) отлична от нуля в центре, т. е. в месте нахождения ядра, и не зависит от направления (сферически симметрична), а для остальных состояний (l > 0) она равна нулю в центре и зависит от направления. Распределение электронной плотности для состояний А. водорода с n = 1, 2 и 3 показано на рис. 3 (оно получено фотографированием специальных моделей); размеры «электронного облака» растут примерно пропорционально n2(масштаб на рис. 3 уменьшается при переходе от n = 1 к n = 2 и от n = 2 к n = 3), что соответствует увеличению радиуса орбит по формуле (6) в теории Бора.
Квантовые состояния электрона в водородоподобных ионах характеризуются теми же четырьмя квантовыми числами n, l, ml и ms, что и в А. водорода. Сохраняется и распределение электронной плотности, только она увеличивается в Z раз и на рис. 3 масштабы нужно уменьшить также в Z раз. Соответственно уменьшаются и размеры орбит.
Действие внешних полей на уровни энергии атома водорода. Во внешнем электрическом и магнитном полях А. как электрическая система приобретает дополнительную энергию. Электрическое поле поляризует А. — смещает электронное облако относительно ядра, а магнитное поле ориентирует определённым образом магнитный момент А., связанный с движением электрона вокруг ядра (с орбитальным моментом Ml) и его спином. Различным состояниям А. водорода с той же энергией Еn во внешнем поле соответствует различная дополнительная энергия DE и вырожденный уровень энергии Еn расщепляется на ряд подуровней (рис. 4). Как расщепление в электрическом поле — Штарка явление, так и расщепление в магнитном поле — Зеемана явление, для уровней энергии А. водорода пропорциональны напряжённости полей.
К расщеплению уровней энергии приводят и малые магнитные взаимодействия внутри А. Для А. водорода и водородоподобных ионов имеет место спин-орбитальное взаимодействие — взаимодействие спинового и орбитального моментов электрона, не учитываемое при выводе основной формулы (4); оно обусловливает т.н. тонкую структуру уровней энергии — расщепление возбуждённых уровней Еn (при n > 1) на подуровни. Наиболее точные исследования тонкой структуры методами радиоспектроскопии показали наличие т. н. сдвига уровней, объясняемого в квантовой электродинамике.