Сейчас все исследователи единодушны в том, что первичные механизмы старения связаны с возрастными изменениями в генетическом аппарате клеток. Первичные не потому, что они возникают раньше других, а потому, что, возникнув, они вызывают существенные нарушения в биосинтезе белка и дальнейшие нарушения в структуре и функции клеток. Не прекращаются споры о том, как и почему нарушается работа генетического аппарата, ведущая к нарушению деятельности, а затем — к гибели клеток. Среди наиболее популярных — так называемая гипотеза ошибок. Предполагается, что в течение жизни возникают ошибки в генетическом коде, что ведет к синтезу ошибочных белков, не выполняющих своей функции, более того, нарушающих деятельность клетки. Однако показано, что нуклеотидный состав ДНК с возрастом не меняется, и убедительных доказательств существования ошибочных белков пока не найдено.
В 1965 г. автор этой книги выдвинул генорегуляторную гипотезу старения, в соответствии с которой нарушения в регулировании генома играют центральную роль в механизме старения. Иными словами, не содержание хранящейся в геноме информации, а ее реализация определяет процессы старения. Очевидно, в большей мере в старении клетки играют роль нарушения в регуляторных генах, контролирующих считывание информации со структурных генов. Можно условно выделить три этапа в нарушении синтеза белка с возрастом. Первый — догеномный, когда возникают множественные нарушения в различных местах клетки, восстанавливаемые, однако, благодаря работе генетического аппарата. Второй — генорегуляторный, определяющий развитие необратимых изменений в синтезе белка, в структуре клетки. Он связан с нарушением реализации генетической информации. Третий — геноструктурный, связан с нарушением структурных генов и содержания генетической информации.
Благодаря генорегуляторным сдвигам изменяется соотношение синтеза различных белков, снижаются потенциальные возможности белоксинтезирующих систем, активируются, "пробуждаются" ранее не работавшие гены.
На основе этих изменений биосинтеза белка и происходит нарушение жизнедеятельности клеток, особенно выраженное с завершением онтогенеза.
Принципиально важно, что при изучении особенностей регулирования генома, структурно закрепленных его свойств можно понять фундаментальные механизмы развития не только старения, но и процесса витаукта. Основные механизмы жизнедеятельности организма, механизмы, направленные на увеличение продолжительности жизни, связаны с особенностями регуляции генетического аппарата. Ведь большинство различий между видами млекопитающих, столь отличающихся по продолжительности жизни, заключается в особенностях регулирования генома. Человек и шимпанзе, эволюция которых разошлась 8-20 млн. лет назад, мало отличаются по составу структурных генов. Продолжительность жизни самого человека, изменившаяся за несколько миллионов лет, связана со сдвигами в регулировании генома. Итак, существует связь между видовыми особенностями регулирования генома и продолжительностью жизни, процессами витаукта и старения. Регуляторный отдел генома, занимающий большую его часть (до 95 % ДНК), чрезвычайно активен; он менее других защищен от внутриклеточных влияний и больше всего подвержен возрастным изменениям.
В последние годы показана мозаичность структуры генов. Структурный ген, содержащий код для построения белка, разделен на отдельные участки — экзоны. Интронами называются участки ДНК, разделяющие экзоны. В процессе транскрипции (считывания) образуется РНК со всех экзонов и интронов. Затем включается процесс сплайсинга. Суть его состоит в следующем — из длинной молекулы РНК вырезаются участки, соответствующие экзонам. Вновь образованная молекула РНК проходит ядерную мембрану и переходит в цитоплазму. Оставшиеся в ядре в результате сплайсинга фрагменты РНК могут оказывать регуляторное влияние на активность генов.
Генорегуляторные изменения при старении могут быть результатом влияния этих фрагментов на считывание генетической информации, результатом изменения под их влиянием химизма ядра. О реальной роли сплайсинга в механизме старения свидетельствует и то, что вещества, подавляющие процесс транскрипции, приводят к увеличению продолжительности жизни, а стимулирующие — укорачивают ее.
Существует ряд доказательств справедливости генорегуляторной гипотезы старения.
1. В ядре клетки находится сложный молекулярный комплекс — хроматин. В нем и заключена молекула ДНК с ее генетической информацией. Кроме того, в состав хроматина входят белки, рибонуклеиновые кислоты, липиды. Хроматин является тем комплексом, благодаря которому осуществляются считывание генетической информации, регуляция генетического аппарата клетки. Вот почему наступающие с возрастом изменения структуры и функции хроматина становятся одним из ведущих генорегуляторных механизмов старения. В старости увеличивается доля неактивного хроматина и уменьшается доля активного (рис. 10). Нарастает явление так называемой гетерохроматинизации, уплотнение хроматина, делающего его менее активным. Хроматин состоит из отдельных частиц — нуклеосом, число и размеры которых изменяются при старении. Уплотнение, компактизация хроматина в старости вызвана тем, что связи между ДНК и белками становятся более прочными, между ними образуются поперечные сшивки. Все это затрудняет считывание генетической информации. Очень важно то, что уплотненные участки хроматина становятся менее доступными ферментам, "ремонтирующим" ДНК, и это способствует постепенному накоплению ее повреждений.
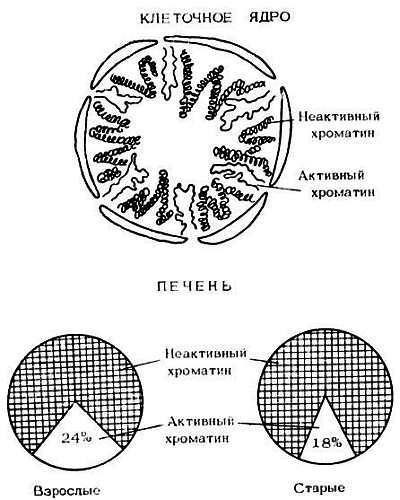
Рис. 10. Снижение количества активного хроматина в старости
2. В хроматине находятся различные группы белков — гистоновые и негистоновые. Предполагается, что гистоны в большей мере подавляют, репрессируют активность генов, а негистоновые белки — активируют, дерепрессируют. При старении изменяется соотношение этих белков и падает количество активирующих — негистоновых. Белки хроматина подвержены различным изменениям. С возрастом снижается так называемое метилирование белков хроматина. Советский исследователь Б. Ф. Ванюшин показал, что это изменяет работу регуляторных генов.
3. На молекуле ДНК синтезируются молекулы рибонуклеиновых кислот — иРНК, тРНК, рРНК. X. К. Мурадян выяснил, что при старении меняется соотношение различных классов РНК. Это говорит о перераспределении в работе отдельных генов.
4. При старении изменяется соотношение синтеза отдельных белков или их блоков, кодируемых различными генами. Многие ферменты, в том числе лактатдегидрогеназа (ЛДГ), креатинфосфокиназа и др., существуют в нескольких разновидностях. Это так называемые изоферменты. Изоферменты, в частности ЛДГ, различаются тем, что состоят из неодинаковых субъединиц, каждая из которых кодируется отдельным геном. Благодаря отличиям в структуре изоферменты более оптимально приспособлены к "работе" в том или ином органе. Субъединицы структуры изоферментов ЛДГ кодируются несколькими структурными генами, связанными с различными генами-регуляторами. За счет этого в молекуле ЛДГ могут сочетаться различные субъединицы, определяя и отличия в свойствах фермента. При старении, как показал А. Я. Литошенко, в связи с изменением регулирования генома возникают сдвиги в соотношении субъединиц в ЛДГ. Эти возрастные сдвиги также можно объяснить перераспределением активности отдельных генов-регуляторов.
В последние годы установлено, что существуют гены, регулирующие синтез отдельных полипептидов, входящих в состав белков. Вот почему изменение в регуляторных генах при старении может вести к неравномерному изменению синтеза различных полипептидов и соответственно полипептидного состава белка. Отсюда качественные изменения в белковой молекуле, в ее вторичной структуре, изменения ее специфических свойств. Среди белков лучше других изучен гемоглобин. Этот белок обеспечивает транспорт кислорода в организме. Он синтезируется в специальных клетках-предшественниках эритроцитов — эритробластах. Молекула гемоглобина состоит из четырех полипептидных цепей, представленных тремя типами — α, β и γ, каждый из которых кодируется отдельным геном. В зависимости от активности этих генов и от синтеза той или иной полипептидной цепи образуются молекулы гемоглобина с различными свойствами.