В типичном случае, из двух электронных орбиталей, принадлежащих разным атомам — формируется единая, т. н. молекулярная орбиталь, электронная плотность которой — принадлежит одновременно двум ядрам, т. е. связывает последние.
Геометрическая форма молекулярной орбитали, и энергия связи, обусловленная ей — могут быть рассчитаны при помощи уравнения Шрёдингера, применённого для случая многоцентровой связи (т. е. связи электрона не с одним ядром, а с двумя и более, что имеет место в молекуле). Электрон молекулярной орбитали образует т. о. стоячую волну, электронная плотность которой рассредоточена между двумя или более ядрами. Некоторые примеры таких орбиталей (и = химических связей) — см. на рис. 227.
Рис. 227 [XIX]. Исходные атомные орбитали (1s и 2p), и образуемые из них, молекулярные орбитали
Электронная плотность связующих (наружных) электронов в молекуле, как было упомянуто выше — может разделяться между ядрами (атомами) неравномерно: она смещается в сторону т. н. более электроотрицательного атома молекулы. Электроотрицательность, определяемая как стремление атома принять дополнительный электрон, или не отдавать уже имеющийся — наиболее высока у атомов галогенов и благородных газов, и является наименьшей — у щелочных металлов, см. рис. 228.
Рис. 228 [XX]
Низкую электроотрицательность щелочных металлов — можно понять уже из того, что у атомов этих элементов, электроны впервые начинают занимать более высокую электронную оболочку, расположенную на единицу расстояния дальше от ядра, чем предыдущая (по упоминавшемуся ранее, правилу площади сфер = оболочек). Экспериментальным свидетельством в пользу этого — является наиболее высокий эффективный радиус атомов щелочных металлов, по сравнению с атомами предыдущих элементов в таблице Менделеева, см. рис. 229. При дальнейшем же заполнении оболочки, второй электрон s-подоболочки, и электроны p-подоболочки — добавляются уже на то же расстояние от ядра, что и первый электрон, но из-за одновременного увеличения числа протонов в ядре, притяжение каждого добавляемого электрона к ядру, а также электронов всего атома в целом — возрастает, и атом сжимается (рис. 229). Т. е. сила связи внешних электронов с ядром, в последовательности от щелочных металлов к галогенам и благородным газам — возрастает, = растёт электроотрицательность атома.
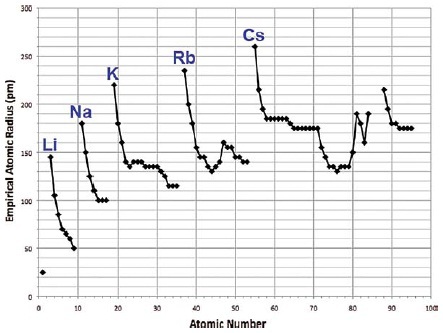
Рис. 229 [XXI]
Теперь учтём увеличение плотности расположения электронов: при переходе от s- к p-подоболочке — оно менее значительное, чем от p к d, и от d к f. Поэтому каждый горизонтальный ряд таблицы Менделеева — заканчивается заполнением именно p-подоболочки. Т. е. прежде чем начинает заполняться d-подоболочка, а тем более, f, более выгодным оказывается начало заполнения более высокого энергетического уровня (= следующей оболочки), с её s-подоболочки, поэтому s- и p-подоболочки — всегда располагаются снаружи атома, а d и f — кнутри. При этом, атомы s-, d- и f-элементов — отдают электроны легче, чем p-элементы (во всех случаях, отдаются, прежде всего наружные, т. е. s-электроны).
Итак, наибольшей электроотрицательностью обладают атомы, у которых близка к завершению p-подоболочка, т. е. атомы, расположенные в самой правой части таблицы Менделеева. Высокая электроотрицательность — определяет химические свойства этих атомов, благодаря которым, они образуют блок т. н. неметаллов, см. табл. 65. Неметаллам — свойственно объединяться только в двухатомные и т. п., небольшие по размерам, молекулы, в то время как металлы (s-, d- и f-элементы) — образуют молекулы в виде монокристаллов, атомы в которых связаны т. н. металлической связью.
Атомы металлов, имея низкую электроотрицательность, легко отдают (наружные, s) электроны, с образованием молекулярной орбитали, электронная плотность которой распределена (делокализована) между всеми атомами в монокристалле (а монокристалл — может включать почти неограниченное число атомов).
Неметаллы же, имея высокую электроотрицательность, в нормальных условиях — либо вообще не отдают электроны друг другу (благородные газы), т. е. не образуют молекул, либо отдают их лишь соседним атомам (галогены, образующие мелкие, двухатомные молекулы (F2, и т. п.), как впрочем и некоторые другие неметаллы (O2, и т. п.)), либо (ещё левее, постепенно приближаясь к металлам), образуют цепочки и другие пространственные структуры (S8, Se8, Cn и т. п.).
Таблица 65 [49] , [50]
Таблица Менделеева (слева — металлы (выделены серым), кроме водорода (H), справа — неметаллы, их отграничивают — металлоиды (выделены светло-серым); свойства отмеченных курсивом, элементов, т. е. 109–111, 113 и 115–118 — не установлены)
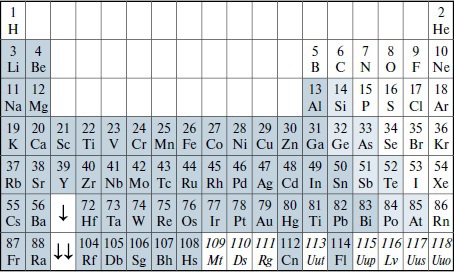
Итак, атомы металлов и неметаллов — различаются химическими свойствами, т. к. образуют различающиеся (по размерам и структуре) молекулы. Таким образом, по химическим свойствам (= определяющим образование более высокого уровня вещества — молекул), все атомы можно разделить на три блока: металлы, неметаллы, и занимающие промежуточное положение между ними, металлоиды (= полуметаллы и полупроводники), такие как Si, и т. п. (см. табл. 65). Таблица Менделеева, как видно, организована так, чтобы группировать атомы со схожими химическими свойствами (т. е. отражать закономерную повторяемость химических свойств атомов, при увеличении их массы), при этом, получаются три вышеупомянутых блока, а также вертикальные и горизонтальные ряды, понятные из представлений о порядке заполнения электронных подоболочек (и оболочек) атомов.
Далее: Из представления об электроотрицательности — выясняется и суть такого вида химической связи как ионная:
Ионная связь — реализуется, когда объединяются атомы с сильно (больше чем (примерно) на 1,7) различающейся электроотрицательностью, например, атомы элементов натрия и хлора (см. рис. 228). В молекуле NaСl, электронная плотность связующих электронов, оказывается очень сильно смещена в сторону атома Cl (где электрон занимает вакансию в p-подоболочке). Атом Cl, принимая эту, дополнительную электронную плотность, обретает т. о. значительный, частичный отрицательный заряд, а атом Na, у которого электронная плотность отнимается — соответствующий положительный. Т. о. атомы в молекуле NaCl, приближаются к состоянию двух связанных ионов, Na+ и Cl–.
В молекуле NaCl, атом Cl достроил электронную p-подоболочку, за счёт электрона атома Na (при этом, из-за неизменного расстояния от ядра, и роста заряда, заполнение вакансии для p-электрона в атоме Cl очень выгодно). Традиционно также представляют (учитывая частично ковалентный характер любой ионной связи), что и Na — достроил свою, s-подоболочку, за счёт электрона атома Cl (учёт этого важен, но в меньшей степени). В целом, хотя суммарная электронная плотность в молекуле NaCl сильно смещена к атому Cl, представляется, что в образовании связи, в этом (одном из типичных) случае, принимают участие два (т. н. валентных) электрона, образующих общую орбиталь, и т. о. связь, для атомов — взаимовыгодна, см. рис. 230.