Живые клетки синтезируют белки, которые обладают и другими функциями. К неферментативным белкам относятся гемоглобин, инсулин, различные антитела. Наиболее распространенным белком, синтезируемым в организме млекопитающих, является коллаген — своего рода строительный материал для костей, кожи или зубов.
Нуклеиновые кислоты выполняют совершенно иную функцию. Они образуют гены — носители всех видов генетической (наследственной) информации. Имеются два типа нуклеиновых кислот: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК), и обе они обнаружены во всех клетках. Несмотря на большое сходство в их химическом строении, во всех известных нам организмах (за исключением некоторых вирусов) генетическую функцию несет ДНК. Генетическая информация, по-видимому, целиком связана с синтезом белковых молекул: их химическим строением, временем и скоростью синтеза.
Как нуклеиновые кислоты, так и белки образованы очень большими молекулами, состоящими из линейно расположенных маленьких субъединиц — "строительных блоков". У нуклеиновых кислот эти строительные блоки называются нуклеотидами. Четыре различных типа нуклеотидов составляют молекулы ДНК и РНК (их строение показано на рис. 1). Генетическая информация кодируется последовательностью нуклеотидов, так же, как информация, содержащаяся в напечатанной странице, кодируется последовательностью букв. Строительными блоками белков являются аминокислоты. В природе их существует великое множество, но только 20 одни и те же 20 аминокислот во всех известных видах — используются при образовании белков (строение аминокислот показано на рис. 2).

Рис. 1. Четыре нуклеотида ДНК и РНК, объединенные вместе, образуют короткий сегмент нуклеиновой кислоты. Каждый нуклеотид состоит из азотистого основания (их названия и обозначения указаны на рисунке), присоединенного к пятиуглеродному сахару (рибозе у РНК и дезоксирибозе у ДНК), который в свою очередь связан с молекулой фосфорной кислоты. Фосфорная кислота связывает нуклеотиды в цепях нуклеиновых кислот
Рис. 2. Белковые аминокислоты
Важной характеристикой аминокислот является оптическая изомерия. Все они (за исключением самой простой — глицина) могут существовать в двух формах, которые отличаются одна от другой так же, как левая рука отличается от правой, т. е. являются зеркальным отражением друг друга (рис. 3). Два оптических изомера идентичны по своим химическим свойствам, но поскольку их невозможно совместить (перчатку с правой руки нельзя надеть на левую), они не могут заменять друг друга при построении белковых молекул или каких-либо иных трехмерных родственных структур. Интересно, что аминокислоты всех известных белков относятся к левовращающим, L(levo), изомерам. В принципе в каком-то ином живом мире все аминокислоты могли бы быть и правовращающими, или D(dextro), изомерами, и этот мир функционировал бы так же, как и земной. Тот факт, что в нашем мире L-аминокислоты оказались предпочтительнее, чем D, вероятно, следует рассматривать как историческую случайность. На какой-то другой планете, где аминокислоты также играли бы определенную роль в биохимии организмов, с равной вероятностью возможны как L-, так и D-формы.
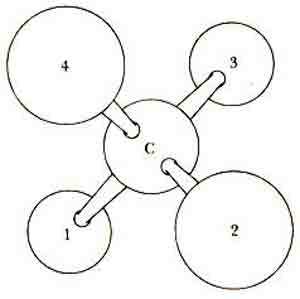
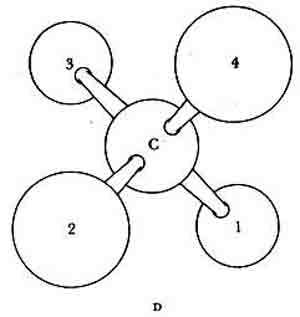
Рис. 3, Оптическая изомерия возникает в случае, если четыре различных радикала связаны с одним и тем же атомом углерода. Как видно из рисунка, образовавшиеся при этом две трехмерные (пространственные) структуры, зеркальные изображения друг друга (D, dextro и L, levo), не совмещаются. В белковые аминокислоты входят следующие радикалы, связанные с центральным атомом углерода: 1 — СООН; 2 — Н; 3 — NH 2; 4 — любой из 20 различных боковых радикалов. Белковые аминокислоты имеют L-конфигурацию за исключением глицина, самой простой аминокислоты, у которой боковым радикалом является Н и зеркальные изображения неразличимы. (Данная схема иллюстрирует лишь возможность пространственного расположения атомных группировок вокруг углерода, а не реальные относительные размеры атомов и радикалов.)
Типичная молекула белка образована одной или несколькими цепочками, называемыми полипептидами, каждая из которых в свою очередь состоит из нескольких сотен соединенных друг с другом аминокислот. Обычно все их 20 типов представлены в каждой такой цепочке (рис. 4). Цепочки свернуты в сложные трехмерные структуры, или конформации, нередко напоминающие спутанный клубок ниток. Особые свойства белковых молекул — как ферментов, так и неферментов — зависят от их конформации. Когда конформация нарушена (в результате процесса, называемого денатурацией), белок перестает функционировать, даже если его аминокислотные цепочки остаются неповрежденными. При соответствующих условиях денатурированные белки могут самопроизвольно ренатурировать — при этом их функции восстанавливаются. Подобное восстановление свидетельствует о том, что трехмерная конфигурация молекулы определяется только последовательностью аминокислот, которая, как известно, кодируется генами.
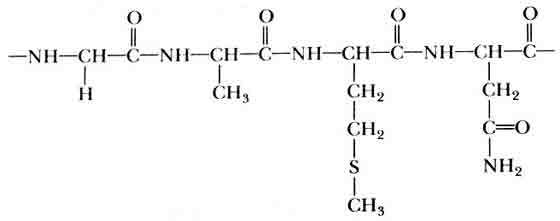
Рис. 4. Объединенные в цепочки аминокислоты образуют белки. На рисунке показан сегмент, содержащий (слева направо): глицин, аланин, метионин и аспарагин
Правила, которые определяют последовательность аминокислот, просты, но доказательство их существования по праву считается одним из величайших достижений биологии XX в. Говоря кратко, последовательность аминокислот, характеризующая ту или иную полипептидную цепь, определяется отдельным геном, и этот ген не выполняет более никаких других функций. Белок, состоящий из одной цепи (или нескольких, но идентичных по последовательности), кодируется единственным геном: белок, состоящий из двух цепей, отличающихся по структуре, кодируется двумя различными генами и т. д. Кодирование осуществляется следующим образом: каждой аминокислоте соответствует комбинация трех нуклеотидов из четырех типов, составляющих ДНК. Из четырех различных нуклеотидов можно составить 64 комбинации по три нуклеотида: ААА, ААГ, АГА и т. д…
Эти буквы соответствуют азотистым основаниям нуклеиновых кислот, изображенным на рис. 1. Каждый триплет кодирует одну аминокислоту, за исключением трех бессмысленных ("нонсенс") триплетов, которые обозначают окончание считывания кода. Таким образом, 20 аминокислотам соответствует 61 триплет, и следовательно, в генетическом коде большинству аминокислот соответствует два или три триплета (см. табл. 1).
Таблица 1. Генетический код
Аминокислота Триплеты оснований
Глицин
ГГТ, ГГЦ, ГГА, ГГГ
Аланин
ГЦТ, ГЦЦ, ГЦА, ГЦГ
Валин
ГТТ, ГТЦ, ГТА, ГТГ
Лейцин
ТТА, ТТГ, ЦТТ, ЦТЦ, ЦТА, ЦТГ
Изолейцин
АТТ, АТЦ, АТА
Серин
ТЦТ, ТЦЦ, ТЦА, ТЦГ, АГТ, АГЦ
Треонин
АЦТ, АЦЦ, АЦА, АЦГ
Аспарагиновая кислота
ГАТ, ГАЦ
Глутаминовая кислота
ГАА, ГАГ
Лизин
ААА, ААГ
Аргинин
ЦГТ, ЦГЦ, ЦГА, ЦГГ, АГА, АГГ